Publié le 13 nov 2007Lecture 19 min
Progestérone, progestatifs et cerveau
M. EL-ETR INSERM UMR 788, Le Kremlin-Bicêtre
En dehors de son rôle dans la régulation de la reproduction, la progestérone affecte le fonctionnement du cerveau en influençant les processus d’anxiété, de dépression et de mémoire. Mais elle intervient aussi dans l’excitabilité cérébrale (épilepsie), et peut exercer des effets bénéfiques ou non sur les tumeurs cérébrales, les pathologies traumatiques et ischémiques (effets anti-œdème et neuroprotecteur) ou les maladies neurodégénératives comme la sclérose en plaques (effets anti-inflammatoire, pro-myélinisant et neuroprotecteur). Les progestatifs pourraient eux aussi moduler l’évolution de ces pathologies, incitant les gynécologues à proposer ou éviter leur prescription.
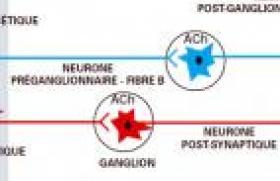
En dehors de son rôle dans la régulation de la reproduction, la progestérone affecte le fonctionnement du cerveau en influençant les processus d’anxiété, de dépression et de mémoire. Mais elle intervient aussi dans l’excitabilité cérébrale (épilepsie), et peut exercer des effets bénéfiques ou non sur les tumeurs cérébrales, les pathologies traumatiques et ischémiques (effets anti-œdème et neuroprotecteur) ou les maladies neurodégénératives comme la sclérose en plaques (effets anti-inflammatoire, pro-myélinisant et neuroprotecteur). Les progestatifs pourraient eux aussi moduler l’évolution de ces pathologies, incitant les gynécologues à proposer ou éviter leur prescription. Sources de la progestérone cérébrale Les stéroïdes présents dans le cerveau ont une double origine : ils peuvent provenir d’une synthèse périphérique par les glandes endocrines (gonades, surrénales, placenta) ou d’un apport exogène (progestérone naturelle ou progestatifs), et franchir aisément la barrière hémato-encéphalique. Mais indépendamment des glandes endocrines, le système nerveux est également capable de synthétiser localement la progestérone et ses métabolites(1) : on parle alors de neurostéroïdes. Leur action n’est plus hormonale, s’exerçant à distance, mais autocrine ou paracrine. Les astrocytes, les cellules oligodendrocytaires (cellules myélinisantes du système nerveux central) et certains neurones comme les cellules de Purkinje du cervelet possèdent l’équipement enzymatique nécessaire à la biosynthèse de la progestérone. La première étape intra-mitochondriale consiste en une coupure de la chaîne latérale du cholestérol par le cytochrome P450scc aboutissant à la prégnénolone. Puis, dans le réticulum endoplasmique, la prégnénolone est convertie par la 3-hydroxy-déshydrogénase (3-HSD) en progestérone. Que son origine soit hormonale ou locale, la progestérone peut être métabolisée dans le système nerveux, d’abord réduite en 5-dihydroprogestérone (5-DHPROG) par la 5-réductase, puis transformée par la 3-hydroxystéroïde-oxydo-réductase (3-HSOR) en 3-5-tétrahydro-progestérone ou alloprégnanolone, composé important car susceptible de moduler rapidement le fonctionnement du récepteur de type A de l’acide amino-butyrique (principal acide aminé inhibiteur de l’activité cérébrale) (GABAAR), récepteur sur lequel se fixent également les barbituriques et les benzodiazépines. Mécanismes d’action La progestérone agit dans le cerveau selon deux types de mécanismes : – génomiques, en régulant la transcription de gènes après liaison à des récepteurs intracellulaires « classiques » (RP) ; – ou non génomiques (rapides), en particulier membranaires(2). La progestérone, son métabolite, réduit la 5-DHPROG et les progestatifs sont capables de se lier aux RP, présents dans les neurones, mais également dans les cellules gliales (astrocytes et oligodendrocytes). Les deux formes B (longue) et A (courte) du RP sont co-exprimées dans la plupart des régions du cerveau, de façon similaire dans les deux sexes, à l’exception des zones impliquées dans la régulation de la reproduction comme l’hypothalamus. Mais le rapport RPB/RPA est variable en fonction de l’âge et de la structure cérébrale : RPB est majoritaire dans le cortex, tandis que la forme A domine dans l’hypothalamus, le cervelet et l’amygdale. RPB et RPA ont des fonctionnalités différentes (régulation de gènes distincts) et RPA peut réprimer RPB. La variabilité du rapport RPB/RPA et le recrutement de co-régulateurs différents conditionnent la spécificité d’action régionale. La progestérone est également capable d’exercer des effets rapides, intracellulaires ou membranaires : – en activant des voies de signalisation comme Src/Ras/Raf/MAPKinases (progestérone), par l’intermédiaire de ses récepteurs intracellulaires RP ; – en interagissant avec des récepteurs de neuromédiateurs : stimulation par l’alloprégnanolone du récepteur inhibiteur GABAA (impliqué dans la régulation de l’anxiété, du stress, de l’humeur), inhibition par la progestérone du récepteur nicotinique de l’acétylcholine et du récepteur sigma 1 (lui-même modulateur du fonctionnement du récepteur excitateur NMDA du glutamate) ; – en modulant des canaux ioniques potassiques, ou calciques (progestérone) ; – en se liant à des récepteurs membranaires spécifiques. Deux types de récepteurs membranaires de la progestérone, présents également dans l’ovaire, ont été isolés chez les humains : • Le PGRMC1 (pour Progesterone Membrane Receptor Component 1, appelé également 25-Dx), récepteur à un domaine transmembranaire, qui serait plutôt situé sur les endo-membranes du réticulum endoplasmique et du golgi, en particulier dans les neurones de l’hypothalamus et du cervelet et dont les voies de signalisations sont encore inconnues. • Le récepteur mPR, cloné en 2003 chez le poisson, présent aussi chez l’homme. Il existe plusieurs isoformes de ce récepteur plasmique, qui présente sept domaines transmembranaires. Couplé à une protéine G inhibitrice de l’adénylate-cyclase, il activerait aussi la voie des MAP kinases. Il n’y a aucune donnée concernant une interaction éventuelle des progestatifs ou de leurs métabolites avec les récepteurs membranaires de neuromédiateurs et/ou les récepteurs PGRMC1 ou mPR de la progestérone. On sait cependant que certains progestatifs utilisés, notamment dans le traitement hormonal de la ménopause (THS) ou en contraception orale (CO), peuvent influencer les taux circulants et/ou intracérébraux d’alloprégnanolone, modulateur positif des récepteurs GABAA cérébraux. On a ainsi pu observer chez la rate ovariectomisée, une augmentation de la synthèse cérébrale (mais pas des taux circulants) d’alloprégnanolone, après administration d’acétate de médroxy-progestérone (mais pas de drospirénone), probablement par l’intermédiaire d’une modulation de l’activité de la 5-réductase cérébrale(3). En revanche, l’administration quotidienne à des rates ovariectomisées, d’un CO associant éthinylestradiol (EE) et lévonorgestrel, entraîne une baisse importante des concentrations plasmatiques et corticales de progestérone et d’alloprégnanolone. Chez la femme, les effets des progestatifs sur la synthèse des neurostéroïdes ne sont pas connus, mais on sait que la prise de certains d’entre eux s’accompagne d’une augmentation (presque tous les progestatifs sauf les dérivés 19-nor, en association avec le 17-estradiol transdermique chez la femme ménopausée), d’une inhibition des taux de l’alloprégnanolone circulante (association contraceptive EE + lévonorgestrel)(4), ou n’a aucun effet (acétate de médroxyprogestérone). Progestérone, progestatifs et tumeurs cérébrales Les astrocytomes Ils synthétisent de la progestérone et expriment les deux récepteurs de la progestérone. PRB prédomine généralement et la prolifération tumorale est inversement proportionnelle au taux d’expression de PRA. Dans les formes graves non opérables, on pourrait proposer l’administration d’un antagoniste des RP comme la mifépristone, mais à ce jour, aucune étude clinique n’a encore été menée dans cette indication. Les craniopharyngiomes Ils n’expriment pas toujours les PR. L’absence de récepteurs de l’estradiol et de la progestérone témoigne de la nature indifférenciée de la tumeur : la détermination du taux d’expression pourrait être utile à la décision de radiothérapie complémentaire. Les micro-adénomes à prolactine Ils sont sensibles à la progestérone, qui inhibe la sécrétion hormonale, diminue la prolifération tumorale et favorise l’apoptose des cellules tumorales in vitro. Chez l’animal, le lévonorgestrel diminue de moitié le volume tumoral et la sécrétion de prolactine dans les tumeurs induites par le diéthylstilbestrol. La mifépristone réduit, elle aussi, la croissance tumorale, peut-être en bloquant les RP hypothalamiques. En clinique humaine, on constate souvent une normalisation de la prolactinémie à la ménopause autorisant l’arrêt du traitement par les agonistes dopaminergiques. Le THS n’est pas contre-indiqué chez ces femmes. Les méningiomes Ils sont plus fréquents chez la femme que chez l’homme. La grossesse favorise leur croissance. Ils sont capables de synthétiser de la progestérone et d’exprimer des RP (autant de forme A que de B). Le taux moyen de RP est de 70 à 90 % dans les formes bénignes, un taux plus bas indiquant un risque élevé de récidive. Dans les méningiomes malins, le taux moyen de RP est de l’ordre de 40 %, un taux plus bas indiquant un grade de malignité élevé. Les progestatifs en contraception comme en THS ne sont pas recommandés. La mifépristone a été proposée dans les formes non opérables : elle entraînerait une amélioration ou une stabilisation du volume tumoral dans 50 % des cas. Progestérone, progestatifs, ischémie et traumatismes cérébraux Des effets neuroprotecteurs de la progestérone et de l’alloprégnanolone ont été décrits dans des ischémies expérimentales par occlusion artérielle chez le rat. Ainsi, lorsque la progestérone est administrée avant l’occlusion de l’artère cérébrale moyenne, voire jusqu’à 2 h après l’induction de l’ischémie, les volumes de l’œdème et de l’infarctus sont fortement diminués, la récupération fonctionnelle meilleure. L’alloprégnanolone est plus efficace que la progestérone, même administrée 2 h, voire 6 h après l’occlusion. Enfin, si on induit une occlusion artérielle globale transitoire, la progestérone diminue fortement la mort neuronale, particulièrement dans l’hippocampe (effet bénéfique sur la prévention des troubles mnésiques secondaires). Dans les traumatismes cérébraux par contusion mécanique du cortex frontal chez le rat, la progestérone diminue l’œdème cérébral et le déficit neurologique secondaire, améliorant les performances mnésiques post-traumatiques de façon identique chez le mâle et chez la femelle. Cet effet est en partie médié par les récepteurs membranaires PGRMC1 présents dans les neurones de la zone traumatisée. Nous avons montré au laboratoire, que la progestérone modulait alors l’expression du principal canal hydrique impliqué dans la résorption de l’œdème, l’aquaporine 4. Aucun traitement n’a formellement fait la preuve de son efficacité dans les traumatismes cérébraux : la méthylprednisolone, longtemps utilisée, s’avère être dangereuse, le magnésium a donné des résultats décevants, l’hypothermie a des effets aléatoires, voire néfastes après 45 ans. Les effets bénéfiques de la progestérone, observés chez l’animal, ont conduit l’équipe de Donald Stein à entreprendre l’essai clinique ProTECT(5), étude randomisée en double aveugle contre placebo, visant à prévenir l’œdème cérébral après traumatisme crânien, par l’administration de progestérone intraveineuse dans un délai maximum de 11 heures après l’accident (encadré ci-dessous). Les évènements mineurs et sévères se sont révélés identiques dans les deux groupes. La progestérone a considérablement réduit la mortalité à 30 jours (13,2 % contre 30,4 % sous placebo), essentiellement parmi les patients dont le coma était sévère, mais avec, dans ce cas, une récupération fonctionnelle médiocre, identique au groupe placebo pour les trois quart d’entre eux. En revanche, chez les patients dont le coma était modéré, une bien meilleure récupération fonctionnelle a été observée à 30 jours dans le groupe progestérone (55,6 % contre 0 % dans le groupe placebo). Une étude de phase III est maintenant en cours, incluant un plus grand nombre de patients, un nombre identique de patients traités par progestérone et placebo (administrés le plus précocement possible), avec un suivi de un an. PROTECT Prévention de l’œdème cérébral par la progestérone chez des traumatisés crâniens – Essai clinique de phase II, randomisé, en double aveugle contre placebo – 100 patients, arrivant à l’hôpital dans les 11 h suivant l’accident – Score de coma : 4 à 12 sur l’échelle de Glasgow (sévère : 4-8 ; modéré : 9-12) – 77 patients traités : progestérone IV dans de l’intralipide 0,7 mg/kg/h x 11 h 0,5 mg/kg/h x 3 j – 33 placebo Pas d’effet indésirable sérieux attribuable à la progestérone Durée du coma sous progestérone > placebo (GCS sévère) Groupe Progestérone à J30 : – 3 fois moins de morts (13 % vs 30,4 %), surtout groupe de score clinique sévère – meilleure récupération dans le groupe de score clinique modéré/placebo (Wright et coll. Ann Emerg Med 2007 ; 49 : 391-40) Progestérone, progestatifs et épilepsie Dans divers modèles animaux d’épilepsie, l’estradiol est pro-convulsivant, alors que la progestérone est anticonvulsivante. Quelle que soit la technique d’induction des crises d’épilepsie généralisée, l’alloprégnanolone et son analogue synthétique la ganaxolone, modulateurs du récepteur GABAA, sont plus anticonvulsivantes que la progestérone. L’interruption d’un traitement chronique par la progestérone entraîne une recrudescence des crises. Mais ces stéroïdes ne sont pas actifs dans toutes les formes d’épilepsie. Ainsi, la progestérone et l’alloprégnanolone n’ont pas d’effet dans l’épilepsie focale. Elles empêchent toutefois la généralisation secondaire de la crise et sont efficaces dans de nombreux modèles d’épilepsie généralisée et d’absence. Chez la femme, on connaît une forme d’épilepsie, dite cataméniale, rythmée par le cycle ovarien : les taux circulants de progestérone seraient relativement bas chez ces femmes et 70 % d’entre elles seraient améliorées par un traitement par la progestérone. L’effet de la progestérone serait, comme chez l’animal, lié à son métabolite réduit et un cas de recrudescence des crises a été rapporté chez une femme épileptique traitée par inadvertance (pour une alopécie) par le finastéride, un inhibiteur de la 5-réductase. La méthode de contraception de choix des jeunes épileptiques reste hormonale, mais avec certaines précautions : pilules de préférence minidosées lorsque l’anti-épileptique n’est pas inducteur enzymatique, alors qu’il faudra préférer des pilules contenant au moins 50 g d’estrogènes lorsque le traitement antiépileptique risque de réduire l’activité des contraceptifs hormonaux. Progestérone, progestatifs et maladies neurodégénératives Maladie de Parkinson Chez la souris, l’administration de progestérone 5 jours avant l’induction de la maladie par le MPTP (1-méthyl-4-phényl-1,2,3,6-tétrahydropyridine) réduit les signes cliniques de la maladie et la perte synaptique dans le striatum. Chez la femme, d’après l’étude KPMC (Kaiser Permanent Medical Care Program) portant sur 367 femmes, le THS ne semble pas jouer un rôle dans la survenue de la maladie. Enfin, chez les femmes atteintes de Parkinson, il n’a pas été observé de corrélation entre la symptomatologie et les taux d’estrogène et de progestérone au cours du cycle menstruel. Maladie d’Alzheimer Une étude incluant un petit nombre de femmes déjà atteintes d’Alzheimer a montré que le THS améliorait le déficit mnésique. Mais contrairement à ce que l’on a pensé pendant de nombreuses années, le THS ne diminuerait pas l’incidence de la maladie. L’étude WHIMS a même montré que le THS augmentait le risque de démence et de maladie d’Alzheimer et ne prévenait pas la survenue de déficits cognitifs légers (Mild Cognitive Impairment)(6). On peut toutefois formuler les mêmes critiques vis-à-vis de cette étude qu’en ce qui concerne les risques de cancer du sein ou de thrombo-embolies rapportés dans l’étude WHI : – début parfois très tardif du THS (jusqu’à 15 ans après la ménopause) ; or, l’étude Cache County Study a en effet montré l’effet neuroprotecteur d’un traitement débuté précocement ; – et utilisation du MPA qui, in vitro, s’oppose aux effets neuroprotecteurs des estrogènes (alors qu’estrogènes et progestérone ont des effets neuroprotecteurs additifs). Sclérose en plaques (SEP) Maladie auto-immune, inflammatoire et démyélinisante, elle évolue par poussées (dans sa forme rémittente, la plus fréquente), atteignant un adulte jeune sur 100 000, avec une prédominance féminine, puisque 2 malades sur 3 sont des femmes. Les stéroïdes sexuels n’interviennent pas dans le déclenchement de la maladie, mais ils peuvent jouer un rôle dans son évolution(7) : ainsi, les poussées sont plus nombreuses après la ménopause ou pendant les règles, elles sont 3 fois moins nombreuses pendant le 3e trimestre de la grossesse (0,2/femme/année vs 0,7 avant la grossesse), avec une recrudescence importante dans les 3 mois qui suivent l’accouchement (1,2/femme/année), quand les taux d’estrogènes et de progestérone sont effondrés. Dans l’encéphalite auto-immune expérimentale (EAE), modèle animal de la maladie, les estrogènes (estriol, EE, et 17-estradiol, même à faible dose) préviennent l’apparition des signes cliniques. Ces observations nous ont conduit à proposer, en collaboration avec l’équipe de Neurologie du Pr Confavreux, une étude clinique de prévention des poussées du post-partum, POPART’MUS (Post-PARTum and Oestradiol in Multiple Sclerosis) (encadré ci-dessus). Cette étude européenne multicentrique, randomisée, en double-aveugle contre placebo, qui a commencé en mai 2005, doit recruter 300 femmes enceintes atteintes de SEP, grâce au réseau EDMUS de surveillance des patients atteints de SEP (European Database for Multiple Sclerosis). Cent cinquante femmes seront traitées en continu par un progestatif, l’acétate de nomégestrol, dès le lendemain de l’accouchement, associé à de l’estradiol en patch au bout de 15 jours ; 150 femmes recevront comprimés et patch placebo. Le traitement sera poursuivi pendant 3 mois, suivi de 3 mois d’observation. La surveillance est avant tout clinique, l’objectif principal de l’étude étant de déterminer si le traitement prévient ou retarde une poussée. Dans un sous-groupe de patientes, une surveillance IRM et biologique à la recherche de marqueurs de poussées sera effectuée. Etude POPART'MUS (coordination : Pr C. Confavreux) – Essai thérapeutique européen (Recrutement : réseau EDMUS*, Lyon) – 300 femmes enceintes atteintes de SEP (150 traitées/150 placebo) – Progestatif 19-nor-pregnane (Lutenyl®) dès le lendemain de l’accouchement, + patch d’estradiol (Dermestril 75 septem®) à partir de la 3e semaine post-partum – 3 mois de traitement/placebo (M1-M3) + 3 mois post-traitement (M4-M6) – Surveillance clinique. Sous-groupe : surveillance IRM, biomarqueurs. – Consentement éclairé : pas de reprise du traitement spécifique (IFNb, Glatiramer...) avant M7 pas d’allaitement possible contraception mécanique jusqu’à M7 – Contre-indications : antécédents personnels ou familiaux d’accident thrombo-embolique, d’HTA ou de cancer. *www.edmus.com Conclusion En dehors de son rôle dans la régulation de la reproduction, la progestérone exerce sur le cerveau des effets neurotrophiques et neuroprotecteurs (réduction de l’œdème cérébral après traumatisme et ischémie, prévention de la toxicité du glutamate in vitro, réduction de la mort neuronale après lésion, régulation de gènes de facteurs de croissance et diminution de la peroxydation des lipides induite par les radicaux libres), des effets anti-inflammatoires (inhibition de la prolifération des cellules microgliales, macrophages du système nerveux central, diminution de la production de cytokines pro-inflammtoires TNF et IL12, par la microglie activée in vitro, diminution de la gliose astrocytaire, également productrice de cytokines pro-inflammatoires, TNF et IL1, après lésion cérébrale). Nous avons également montré au laboratoire que la progestérone pouvait exercer des effets pro-myélinisants : accélération de la myélinisation de tranches de cervelet murin in vitro, meilleure remyélinisation après lésion démyélinisante induite chez le rat âgé. Les effets des progestatifs sur le cerveau sont moins bien connus. On sait cependant que le MPA, contrairement à la progestérone ou à la 19-nor-progestérone, ne protège pas les neurones en culture contre l’effet toxique du glutamate, car il interagit différemment avec la voie de signalisation des MAP kinases. Certains effets de la progestérone sont dus à sa conversion en alloprégnanolone, mais l’administration de progestatifs ne s’accompagne pas toujours d’une augmentation des taux circulants et/ou intracérébraux d’alloprégnanolone ; ainsi, chez l’animal, le MPA n’a pas d’effet sur les taux circulants, mais majore la concentration cérébrale d’alloprégnanolone, alors que la drospirénone ne majore ni le taux sanguin ni les taux cérébraux. Enfin, l’augmentation de la concentration d’alloprégnanolone peut varier selon les régions cérébrales et peut être majorée en fonction du type de progestatif utilisé, par l’adjonction d’estradiol. En conclusion (tableau), la progestérone peut être bénéfique dans les traumatismes cérébraux (essai clinique de phase III en cours), les lésions ischémiques, certaines formes d’épilepsie, et dans certaines maladies neuro-dégénératives comme probablement la SEP (essai clinique en cours). Les antagonistes des récepteurs de la progestérone pourraient être utiles dans les formes inopérables d’astrocytomes et de méningiomes, mais aucune étude clinique n’a encore été entreprise. L’utilité de la progestérone et des progestatifs dans la prévention de la maladie d’Alzheimer reste à démontrer.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :