Publié le 13 jan 2012Lecture 31 min
La dysautonomie en 2011
P. LOZERON, Service de Neurologie, CHU Bicêtre, Le Kremlin Bicêtre
Le terme dysautonomie fait référence à une série de désordres du système nerveux autonome responsables de manifestations cliniques très variées, souvent méconnues ou négligées, mais qui peuvent conduire à consulter en cardiologie et en neurologie. Tour d’horizon empruntant à de nombreux champs de la pathologie.
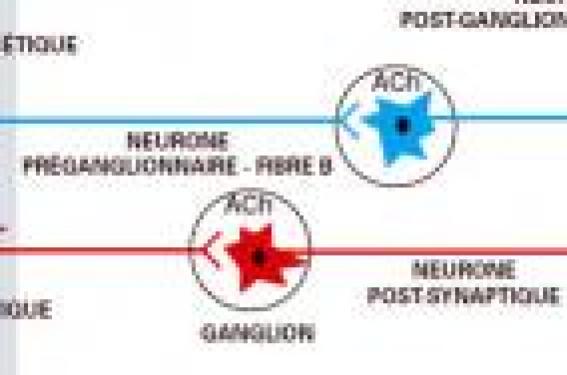
Le système nerveux autonome (SNA) correspond à la partie du système nerveux responsable du contrôle des fonctions involontaires et inconscientes des organes. Comme le système nerveux somatique, il est composé de voies et/ou de structures centrales et périphériques. Des atteintes de chacune d’elles peuvent être à l’origine d’une dysautonomie clinique. Il existe ainsi de multiples pathologies du système nerveux autonome ayant une grande diversité de mécanismes générateurs, des symptômes présentés, de mode évolutif et d’atteinte plus ou moins complète du SNA. Elles doivent être différenciées des atteintes neuro-endocrines comme la maladie d’Addison, le pan hypopituitarisme, le phéochromocytome ou le déficit en dopamine- P-hydroxylase. Structures du système nerveux autonome Les voies sensitives afférentes du système nerveux autonome transportent vers la moelle, la protubérance et surtout l’hypothalamus des informations en provenance des vaisseaux, du coeur et plus généralement de tous les organes du thorax, de l’abdomen et du pelvis recueillies grâce à des ré cepteurs de mécanisme d’action variés (mécano-, thermo-, baro-, osmorécepteurs). Des réponses en grande partie inconscientes et automatiques, mais pas complète ment indépendantes du contrôle volontaire sont alors retransmises aux vaisseaux, cœur et organes en réaction aux variations de l’environnement, telles que le stress, la température, la prise alimentaire ou le passage à la position debout. Les voies efférentes sont typique - ment composées de deux systèmes agissant le plus souvent en opposition : le système sympathique (SNS) et le système parasympathique (SNPS). Il s’agit de deux voies structurellement et fonction nellement distinctes, formées chacune de deux neurones. Un neurone préganglionnaire fine ment myélinisé (fibres B), faisant relais dans un ganglion végétatif avec un neurone postganglionnaire amyélinique (fibres C), qui se projette sur l’organe cible (figure). Les deux principaux neurotransmetteurs mis en jeu sont l’acétylcholine et la noradrénaline. Figure. Voies efférentes du système nerveux autonome. • Le système nerveux parasympathique permet principalement de mettre l’organisme au repos (« rest and digest » des Anglo- Saxons). Il fonctionne de façon focale permettant une réponse limitée à un organe en particulier. Il véhicule des informations via les nerfs crâniens et les nerfs sacrés. Ses neurones préganglionnaires sont cholinergiques et font relais dans des ganglions végétatifs localisés à proximité des organes cibles avec un deuxième neurone également cholinergique. • Par opposition, le système nerveux sympathique permet la réponse au stress (« fight or flight » des Anglo-Saxons). Le neurone préganglionnaire cholinergique fait relais au niveau de la chaîne sympathique paravertébra le ou au niveau des plexus prévertébraux (plexus coeliaque…) avec un neurone postganglionnaire le plus souvent noradrénergique, à l’ex ception des fibres choli nergi ques innervant les glandes sudoripares. Un autre neurotransmetteur im portant du SNS est l’adrénaline libérée directement par la médullo-surrénale sous le contrôle des projections du neurone préganglionnaire. • Le système nerveux entérique (SNE) peut être individualisé comme la troisième voie du SNA pour des raisons à la fois morpho logiques et fonctionnelles. Il est composé de deux plexus situés dans la paroi du tube digestif. Le plexus d’Auer bach est le plus volumineux. Il contrôle la motricité du tube digestif. Le plexus de Meissner contrôle le flux sanguin local et les sécrétions gastro-intestinales. Même si le SNE peut à lui seul assurer la mobilité digestive, le tube digestif est également sous le contrôle du SNS (inhibition des sécrétions, des contractions et du tonus, à l’exception des sphinc ters) et du SNPS (augmentation des sécrétions et des contractions). Le système nerveux entérique (SNE) peut être individualisé comme la 3e voie du SNA. Les ganglions végétatifs et la moelle épinière jouent un rôle dans la régulation du SNA, mais l’organisation des réponses du SNA est principalement supramédullaire. Collectivement, l’ensem ble des régions d’interconnexions permettant la régulation du SNA est appelé système nerveux auto nome central. Il comprend diverses zones corticales, des noyaux thalamiques et sous-thalamiques et différents noyaux du tronc cérébral. L’hypothalamus est la principale structure du système nerveux autonome central assurant l’homéostasie. Par l’intermédiaire du noyau du tractus solitaire, de la réticulée, du système limbique, de la moelle épinière, il reçoit des informations sensitives et sensorielles par des afférentes médiées par les système nerveux somatique et autonome. Les ré - ponses hypothalamiques sont médiées, d’une part, par le système neuro-endocrine et, d’autre part, par le SNA. Cette opposition entre voies centrales et périphériques du SNA est cependant un peu réductrice com - me en atteste la découverte de connexions directes d’organe à organe sans relais dans le système nerveux central et la description de ganglions végétatifs ayant des projections mixtes sympathiques et parasympathiques. Symptômes Le système nerveux autonome agit sur les différents organes. Il peut ainsi altérer le fonctionnement des systèmes cardiovasculaire, respir toire, digestif, urinaire, reproductif, sudoripare, pupillaire, ainsi que la réponse au stress. Les principaux symptômes secondaires à une atteinte du SNS sont l’hypotension orthostatique, l’anhidrose, les troubles de l’éjaculation et le signe de Claude Bernard- Horner. La xérostomie et la xérophtalmie, les troubles de l’érection, les rétentions urinaires, certaines atteintes du ré - flexephotomoteur et l’absence de variabilité du rythme cardiaque sont celles des atteintes parasympathiques (1). Les troubles de la mobilité intestinale comme la satiété précoce, certaines douleurs abdominales postprandiales, vomissements, diarrhées, constipation ou pseudo-obstruction intestinale peuvent témoigner d’une atteinte du SNE. • L’hypotension orthostatique (HO) est le prototype de l’atteinte cardiovasculaire du SNA. Elle est définie comme une chute de 20 mmHg de la tension systolique ou de 10 mmHg de la tension diastolique dans les 3 minutes suivant le lever après un repos d’au moins 5 minutes (2). Cependant, dans la population normale, la chute de la tension systolique en orthostatisme au 97,5 persentile étant de 29 mmHg, une chute de 30 mmHg est souvent utilisée pour diagnostiquer une HO. Les symptômes peuvent être une sensa tion de tête vide, de vertiges, de vision floue, de faiblesse, de troubles cognitifs, de nausées, de palpitations, de tremblements, de céphalées ou de douleurs du cou. Si un patient présente ce type de symptômes sans hypotension orthostatique documentée, il con vient de répéter les mesures et de s’assurer des conditions techniques de réalisation du test. En particulier, la recherche doit être effectuée le matin avec un brassard situé à hauteur du cœur et ne pas arrondir les valeurs mesurées. Il convient également d’éviter les mesures postprandiales surtout après les repas chauds et riches en hydrates de carbone qui favorisent l’hypotension (3). Enfin, chez certains patients, la chute de la tension peut survenir après plus de 10 minutes d’orthostatisme justifiant, en présence d’une symptomatologie évocatrice, un enregistrement prolongé de la tension si les premières valeurs sont normales. Nosologie De nombreuses maladies du système nerveux périphérique et, à un moindre degré, du système nerveux central sont responsables de troubles dysautonomiques. Elles peuvent affecter les fonctions sympathiques ou parasympathiques à des degrés divers, mais sou vent les deux de façon concomittante. Nous ne citerons que les pathologies où l’atteinte du SNA est au premier plan. Neuropathies périphériques Dans la plupart des neuropathies périphériques, l’atteinte du système nerveux autonome est infra clinique, mais pour certaines d’entre elles, elle représente un signe cardinal de la pathologie (4-5). Neuropathie diabétique (6-7) Le diabète est la cause la plus fréquente de neuropathie dans le monde. La dysautonomie se manifeste généralement après plusieurs années d’évolution, à la fois chez les diabétiques de type 1 ou les diabétiques de type 2, bien qu’une atteinte infraclinique puis - se être détectée très précocement. Sa prévalence varie en fonction des séries en raison des modalités de diagnostic et de l’hétérogénéité des populations étudiées. Des signes de dysautonomie sont retrouvés chez 54 % des diabétiques de type 1 et 73 % des diabétiques de type 2 (8). La dysautonomie peut atteindre à la fois les voies sympathiques et parasympathiques. Elle se manifeste par une dysfonction d’un ou plusieurs organes (coeur, système génitourinaire, système gastro-intestinal, etc.) et est souvent associée à une neuropathie à pré dominance sensitive longueur-dépendante dite « neuropathie diabétique ». • L’atteinte cardiovasculaire est la plus fréquente. Elle est associée à une augmentation de la mortalité. Elle se manifeste surtout par une hypotension orthostatique, une intolérance à l’exercice et une ischémie myocardique silencieuse. L’hypotension orthostatique est le plus souvent due à une atteinte des fibres sympathiques efférentes vasomotrices splancniques, en association à une diminution de la résistance vasculaire cutanée. Elle peut être majorée par l’effet vasodilatateur de l’insuline (9), une hypovolémie ou d’autres médicaments (bêtabloqueurs, antihypertenseurs, antidépresseurs tricycliques, etc.). L’intolérance à l’effort est liée à un dysfonctionnement sympathique et parasympathique entraînant principalement une réduction du débit cardiaque et de la redistri bution du débit sanguin vers les muscles squelettiques. L’origine de l’ischémie silencieuse (IS) chez les diabétiques est controversée. Une participation de l’in - sensibilité à la douleur est suggérée. De plus, l’IS est nette ment plus fréquente en cas de neuropathie dysautonomique associée et donc être facilement évoquée chez un sujet diabétique, car elle majore la mortalité en cas d’infarctus. La tachycardie de repos est particulièrement fréquente. Elle est attribuée à une atteinte parasympathique souvent plus précoce que l’atteinte sympathique. Elle doit rendre prudente toute activité physique soutenue. • Les troubles gastro-intestinaux ne sont pas rares, mais habituellement modérés. La constipation est l’atteinte la plus fréquente (60 %). Elle est associée à une atonie du côlon. Les troubles de la mobilité gastrique sont moins fréquents (25 %) et souvent asymptomatiques, mais peuvent devenir très invalidants surtout chez les diabétiques de type 1. Ils sont en rapport avec l’atteinte parasympathique médiée par le nerf vague (X). Ils se manifestent par une satiété précoce, des vomissements, des douleurs épigastriques ou une anorexie. Ces symptômes doivent en premier lieu faire rechercher une authentique pathologie digestive (ulcère, gastrite, etc.). Les nausées et vomis sements peu vent évoluer par crises ou survenir par périodes de semaines ou mois. La gastroparésie peut entraîner un con trôle irrégulier de la glycémie. Les diarrhées, retrouvées chez 20 % des patients, sont typiquement vespérales et postprandiales. Elle sont dues à une hypermobilité digestive par diminution de l’inhibition sympathique, mais d’autres mécanismes sont en cause : pullulation microbienne sur hypomobilité colique, insuffisance pancréatique, etc. Les troubles de la mobilité gastrique se manifestent par une satiété précoce, des vomissements, des douleurs épigastriques ou une anorexie. • L’atteinte génito-urinaire provoque une impuissance et une gêne à la vidange vésicale. La diminution de la puissance sexuelle à une prévalence de 50 %. Elle est d’origine multifactorielle : atteinte vasculaire, troubles endocriniens, cause nutritionnelle, facteurs endocriniens, effet secondaire des médicaments. La part neuropathique agit par limitation de l’action de l’acétylcholine sur le processus de l’érection. L’éjaculation rétrograde est due aux lésions des fibres efférentes sympathiques qui coordonnent la ferme ture du sphincter interne de la vessie et l’ouverture du sphincter externe pendant l’éjaculation. Les fibres parasympathiques efférentes à destinée vésicale ont une action excitatrice sur la motilité vésicale. Leur atteinte est responsable de la dysurie avec vidange incomplète, augmentation du résidu postmic tionnel, diminution du débit mictionnel et distension vésicale. Neuropathie par amylose AL C’est la forme la plus commune d’amylose. Elle est due à la présence de chaînes légères qui se déposent dans les tissus sous forme d’amylose. Il s’agit d’une atteinte systémique très grave avec hépatomégalie, macroglossie, ecchymoses cutanées, cardiomégalie et atteinte rénale. La neuropathie périphérique est présente chez 20 % des patients. L’atteinte dysautoomique est fréquente, elle se manifeste surtout par une HO, une atteinte gastro-intestinale (alternance diarrhées-constipations) et urogénitale. L’espérance de vie est de quelques mois, surtout en cas d’atteinte cardiaque. Neuropathie Héréditaires • La neuropathie amyloïde familiale est une neuropathie héréditaire autosomique dominante d’évolution progressive fatale en une dizaine d’années sans traite ment. Dans la majorité des cas, elle est due à des dépôts d’amylose secondaires à différentes mutations du gène de la transthyrétine (TTR), dont la plus fréquente est la mutation portugaise Met 30. La TTR mutée, synthétisée essentiellement par le foie se dépose dans les tissus et est responsable d’une atteinte cardiaque, voire rénale ou oculaire, ainsi que d’une neuropathie affec tant initialement les petites fibres, puis progressant vers une neuro pathie sensitivo-motrice mortelle. L’atteinte dysau tonomi - que est fré quente, surtout chez les patients portugais. Se ren contrent essentiel lement une HO parfois sévère, des troubles diges tifs hauts (lenteur à la digestion, nausées, voire vomissements évo luant par - fois par crises de plusieurs jours, voire plusieurs semaines), ou bas (diarrhées parfois très invali dantes, constipation ou alternance des deux). Des troubles de la puissance sexuelle sont fré quents, alors que la dysurie est plus rare. Le traitement est symptomatique car rares sont les patients pour les quels la trans plantation hépati que (traite ment de référence actuel de la maladie) permet une régression de l’atteinte dysautonomique. • Les neuropathies dysautonomiques héréditaires sont un groupe de neuropathies rares asso - ciées à des troubles sensitifs (Here - ditary sensory and autonomic neuropathies, HSA). Il en existe cinq types individualisés. Dans le type III (Ma - ladie de Riley-Day, Familial dysa tonomia), la dysautonomie est au premier plan. La maladie atteint les jeunes enfants d’origine juive ashkénaze selon une transmission autosomique récessive. Le locus pathogène est situé sur le bras long du chromosome 9. Il est responsable de l’absence de fibres amyéliniques. La maladie débute à la naissance avec troubles de la succion, de la déglutition et des vomissements. Les larmes sont absentes et les patients présentent une insensibilité des membres à la douleur et à la température. La mortalité dans l’enfance est élevée. Les autres HSA s’associent égale - ment à des troubles dysautonomiques souvent moins marqués (type I : acropathie ulcéromutilante associée à une anhydrose ; type II : neuropathie sensitive con génitale affectant à la fois les petites et les grosses fibres, avec troubles trophiques associés à une hyperhydrose, une constipation, voire des épisodes apnéiques ; type IV : insensibilité congénitale à la douleur, associée à une anhydrose et un retard mental ; et le type V : proche du précédent, mais sans retard mental. • La maladie de Fabry est due à l’accumulation de globotriaosylcé - ramide principalement dans les lysosomes de nombreux types cellulaires (système nerveux, les vais - seaux, etc.). Il s’agit d’une affection héréditaire récessive liée à l’X, responsable d’un déficit en alphaga - lactosidase A. Elle se manifeste chez l’homme jeune par une néphro pathie progressive, des douleurs des extrémités évoluant par crises cédant avec le temps, associées à des angiokératomes, des accidents vasculaires, des opacités cornéennes. Les troubles gastro-intesti naux à type de douleurs abdominales postprandiales et de nausées, voire de vomissements sont par fois au premier plan. Les autres atteintes dysautonomiques sont l’anhidrose, la xérostomie, la xérophtalmie et l’impuissance. Le traitement enzymatique de substitution n’a pour l’instant montré son efficacité que sur la néphropathie. • Les porphyries hépatiques sont des pathologies autosomiques dominantes de la synthèse de l’hème. Elles associent une neuro pathie périphérique avec des signes dysautonomiques, des lésions cutanées et une atteinte du système nerveux central. La porphyrie va riégata et la por - phyrie aiguë intermittente sont deux affections dans lesquelles la dysautonomie est une des caractéristiques majeures. L’évolution se fait par crises, déclen chées par certains médicaments, le jeûne, le stress ou une infec tion. Elles associent douleurs abdominales, neuropathie à pré dominance motrice pseudo-polyradiculo - névritique et troubles dysautonomiques pouvant reflé ter à la fois une atteinte du SNPS et du SNS, mais le SNPS est le plus sou - vent atteint (hyperactivité vagale). Une détresse respiratoire est possible. Des lésions cutanées bulleuses peuvent également se voir dans la porphyrie variégata. La récupération inter critique est la rè gle, y compris pour l’atteinte dysautonomique, mais des séquelles peuvent survenir (10-12). Les porphyries hépatiques associent une neuropathie périphérique avec des signes dysautonomiques, des lésions cutanées et une atteinte du système nerveux central. Neuropathie auto-immunes • Le syndrome de Guillain- Barré est une neuropathie sensitivo-motrice aiguë d’origine autoimmune. Des signes dysau tono - miques, tels qu’une tachycar die si nusale, des pauses sinusales et autres tachy- ou brady-arythmies, labilité tensionnelle, troubles gastro-intestinaux, troubles sphinctériens ou troubles vasomoteurs, peu vent se rencontrer (13). Ils peuvent égale ment être la manifestation initiale de la maladie, et leur présence est corrélée à une augmentation de la mortalité. Ils sont le plus souvent au second plan derrière les troubles sensitifs et moteurs, mais sont plus nets dans les formes axonales de SGB. Cependant, ils sont imputés à une at teinte des fibres afférentes des barorécepteurs artériels du IX et X, mais également des fibres afférentes parasympathiques du X in nervant le cœur et des fibres sympathiques sudoripares et vasomotrices (14). • Les ganglionopathies dysautonomiques auto-immunes (pandysautonomie, neuropathie dysautonomique aiguë ou subaiguë) sont des neuropathies aiguës ou subaiguës se présentant essentiellement par des troubles dysautonomiques affectant à la fois le système nerveux sympathique et le système nerveux parasympa - thique, ou uniquement l’un des deux. Leur association à des petits troubles sensitifs et moteurs, leur mode d’installation rapide et la présence d’une dissociation albumino-cytologique les ont fait con - sidérées comme des variantes du syndrome de Guillain-Barré. Elles associent hypotension orthostatique, anhidrose et troubles gastrointestinaux. Environ 40 % des patients récupèrent en quelques mois ou années, mais la plupart gardent des séquelles. Ces neuropathies peuvent s’associer à une infection, un cancer ou une connectivite. Récemment a été mise en évidence la présence d’anticorps dirigés contre la sous-unité alpha3 des récepteurs nicotiniques de l’acéthycholine situés au niveau des ganglions végétatifs. Quelques rares formes chroniques sont également rapportées (15), mais la présence d’une dysautonomie « pure » d’évolution chronique doit faire envisager en premier lieu une défaillance autonome pure (PAF, Pure autonomic failure). • Différentes maladies rhumatologiques auto-immunes sont associées à une atteinte du système nerveux autonome périphérique (16). Des atteintes du système nerveux central et périphérique sont rap portées dans le lupus. Une atteinte dysautonomique cardio vasculaire rare et souvent asymptomatique, impliquant à la fois le système sympathique et parasympathique, est parfois retrouvée (17). Elle n’est pas associée au degré d’activité de la maladie, à la pré sence de troubles neuropsychiatriques ou d’une neuropathie périphérique, mais elle est corrélée à la présence d’anticorps anti phospholipides. Dans la polyarthrite rhumatoïde, l’atteinte dysautonomique est assez rare. Elle intéresse surtout les fonc tions sudoripares et le système cardiovasculaire. La présence d’anticorps circulants antinerve growth factor (NGF) dans les ganglions cervicaux et le nerf vague a été retrouvée sans que leur pathogénicité ne soit démontrée. Le syndrome de Sjögrenest une maladie auto-immune affectant les glandes exocrines, ainsi que d’autres tissus, dont le système nerveux. Une atteinte à la fois sympathique et parasympathique a été mise en évidence principalement sur des tests évaluant le système cardiovasculaire. Sont essentiellement rapportés des cas d’hypotension orthostatique et de troubles sphinctériens. Par ailleurs, la sécrétion des glandes exocrines étant sous la dépendance du SNA, une participation neurologique au syndrome sec est possible bien que non démontrée à l’heure actuelle. Les mécanismes mis en cause dans la dysautonomie sont multiples : mise en évidence d’anticorps ou de cytokines interférant avec la signalisation nerveuse ou réactions inflammatoires. Dysautonomies périphériques paranéoplasiques (18) Le syndrome de Lambert- Eaton est dû à la présence d’anti - corps anticanaux calciques présynaptiques de la jonction neuromusculaire (VGCC). Parmi les différents sous-types de canaux calciques, le type P/Q est celui présent principalement à la jonc tion neuromusculaire et au niveau des nerfs du système nerveux autonome (VGCC P/Q) (19). Les symptômes apparaissent de façon subaiguë et associent déficit moteur, aréflexie et des signes de dysautonomie qui prédominent sur le système parasympathique (bouche sèche et impuissance surtout, mais aussi vision trouble et troubles de la sudation). La dysautonomie, que sa forme soit paranéoplasique ou non, peut se voir, mais elle est plus fréquente chez les sujets âgés atteints de cancer (20). Le syndrome de Lambert-Eaton est dû à la présence d’anticorps anticanaux calciques présynaptiques de la jonction neuromusculaire (VGCC). Exceptionnellement, la myasthénie avec thymome peut s’associer à des signes de dysautonomie allant de la gastroparésie, for me la plus commune, à une pandy sautonomie. Ces patients présentent fréquemment des anticorps antiacide glutamique décarbo xylase- 65 (GAD65). Des anticorps anticanaux potassiques voltagedépendant peuvent également être identifiés. L’atteinte est sympathique et parasympathique. Elle survient dans tous les cas chez des patients présentant des anticorps anti-récepteur post-synaptique de l’acétylcholine, dont 42 % d’entre eux présentent également des anticorps anti-récepteur à l’acétylcholine des ganglions végéta tifs (21). Les neuropathies paranéoplasiques se développent pour la plupart de façon subaiguë (neuro - pathie de Denny-Brown). Dans 10 à 30 % des cas, elles sont associées à une atteinte dysautonomique, surtout chez les patients présen tant des anticorps anti-Hu ou anticorps anti-CV2. Les troubles de la motricité digestive sont les plus fréquents. Sont également constatés une instabilité tensionnelle ou une hypotension orthostatique et des troubles sphinctériens (18,22-24). Neuropathies infectieuses • Le botulisme est dû à une atteinte présynaptique de la jonction neuromusculaire par la neurotoxine de Clostridium botu linum. Les manifestations cliniques débutent 12-36 heures après l’ingestion d’aliments contaminés par Clostridium botulinum. L’évolution clinique est caractéristique. L’atteinte des nerfs crâniens est inaugurale et symétrique. Elle se manifeste par un ptosis, une diplégie faciale, une dysarthrie, une dysphagie, parfois une diplopie qui évolue vers une paralysie descendante symétrique (cou, membres supérieurs puis membres inférieurs). L’atteinte du diaphragme peut conduire à un arrêt respiratoire. Les troubles dysauto nomiques dus à un déficit cholinergique important peuvent être les seules manifestations cliniques de la maladie. Ils associent une vision trouble, une xérostomie, une xérophtalmie, une hypotension orthostatique, une dysurie et une mydriase aréactive à la lumière et à l’accommodation (25). • La diphtérie peut être respon - sable d’une neuropathie (68 % des cas) avec dysautonomie dont l’intensité est corrélée au degré d’intoxication. Elle survient envi ron 15 jours après l’atteinte pharyngée et elle est un signe de gravité de la maladie. Elle débute par une atteinte des nerfs crâniens (ptosis, dysarthrie). Une tétraparésie avec aréflexie apparaît en suite, avec une atteinte sensitive pouvant conduire au pseudo tabes (50 % des cas). L’atteinte dysautonomique est constante. Elle est marquée par une tachycardie sinusale, une hypotension orthos tatique, une rétention d’urine et une anhidrose importante (26). La paralysie de l’accommodation est précoce dans 10 à 50 % des cas, mais par opposition au botulisme, la réponse pupillaire à la lumière est préservée. • Au cours de l’infection HIV, des troubles dysautonomiques cli - niques ou infracliniques peuvent se rencontrer. La prévalence de l’atteinte cardio-vagale est estimée à 15 % et les troubles de la mobilité pupillaire à 65 %. Chez les patients à un stade avancé de la maladie, une atteinte à la fois sympathique et parasympathique a été authentifiée et corrélée à une augmentation de mortalité par arrêt cardiorespiratoire. Depuis l’utilisation des antirétroviraux dans les pays dits développés, les troubles dysautonomiques semblent nettement prédominer sur l’atteinte parasympathique. L’implication des médicaments dans cette dysautonomie est possible (27-28). Au cours de l’infection HIV, la prévalence de l’atteinte cardio-vagale est estimée à 15 % et les troubles de la mobilité pupillaire à 65 %. Neuropathies toxiques • La prise chronique d’alcool peut être responsable d’une neuropathie dysautonomique corrélée à la neuropathie sensitive et à la dose totale cumulée d’alcool ingérée (29). Il s’agit surtout d’une dysfonction parasympathique due à une atteinte du nerf vague pouvant en traîner une dysphagie ou une dysarthrie. Plus rare, l’atteinte sympathique peut entraîner une hypo tension ou une hypothermie. Elle semble associée à une mortalité accrue (30). • Les intoxications à la pyridoxine associent une neuropathie sensitive à des signes dysautonomiques dans les formes aiguës. Les intoxications impliquant certains métaux lourds peuvent également atteindre le système nerveux autonome : thallium (neuropathie douloureuse, essentielle ment sensitive, prédominante sur les grosses fibres, parfois associée à une tachycardie et à une hyper tension ; les formes les moins aiguës sont associées à une alopécie caractéristique de l’intoxication, une hyperkératose, voire des stries unguéales de Mees ; arsenic (neuropathie sensitive ataxiante et trou blessudomoteurs distaux) ; mer cure (acrodynies associées à une hyperhydrose, une tachycardie et une hypertension), n-hexane (glue sniffing) neuropathie subaiguë et HO-impuissance et anhydrose distale, acrylamide neuropathie sensitive et troubles sudomoteurs. • D’autres médicaments peuvent être à l’origine d’une neuropathie dysautonomique par un mécanisme toxique. Il s’agit en particulier des médicaments anticancéreux. La vincristine peut entraîner des neuropathies dysautonomiques après une dose cumulée de plus de 50 mg par altération des micro - tubules affectant plus nettement les fibres amyéliniques (31). L’atteinte est sympathique et parasympathique. Elle se manifeste par une hypotension orthostatique, une rétention urinaire, voire des trou bles de la mobilité gastro-intestinale, et s’associe à la neuropathie à prédominance sensitive douloureuse distale. La neuropathie est généralement réversible en quel ques semaines ou quelques mois, mais des séquelles peuvent persis ter. Audelà d’une dose cumulée de plus de 825 mg/m2 decisplatine, une neuropathie dysautonomique peut également survenir sous forme d’une hypotension orthostatique ou d’iléus paralytique. La neuronopathie sensitive ata - xiante, le signe de Lhermitte, l’atteinte ototoxique et la névrite optique rétrobulbaires sont cependant plus fréquents. Le bortézomib peut également donner une hypo tension orthostatique réversible en association à une neuropathie douloureuse des petites fibres qu’il conviendra de différencier d’une amylose dans un contexte d’hémopathie. Le syndrome de tachycardie posturale orthostatique (POTS) (32) Il est défini comme une intolérance à l’orthostatisme parfois très invalidante (palpitations, fatigue, tête vide, intolérance à l’exercice, nausées, troubles de la concentration, tremblements, lipothymies ou syncopes) accompa gnée d’une augmentation de 30 pulsations/min du rythme cardia que ou d’une tachycardie à plus de 120/min dans les 10 minutes suivant l’orthostatisme. Deux formes sont décrites. La plus fréquente est la dysautonomie partielle (PD). Elle surviendrait après un épisode infectieux viral, un sepsis, une chirurgie, un traumatisme ou une grossesse. Elle serait due à une dénervation partielle du SNA altérant les capacités de résistance vasculaire périphérique. La forme hyperadrénergique (H) est d’apparition plus progressive. Les patients rapportent un tremblement des extrémités, une anxiété et une sudation anormale des mains en position debout. Ils présentent souvent, outre la tachycardie d’orthostatisme, une hypertension d’orthostatisme. Il a été retrouvé chez certains d’entre eux une mutation rendant le récepteur de recapture de la noradrénaline peu fonctionnel (33). Il a été retrouvé chez certains d’entre eux une mu tation rendant le récepteur de recapture de la noradrénaline peu fonctionnel. Des formes secondaires dues à un déséquilibre entre une dénervation vasculaire périphérique et une préservation relative de l’innervation cardiaque existent. Elles se rencontrent dans le diabète, l’amylose, l’intoxication alcoolique, etc. Dans d’autres cas, le POTS peut être une manifestation d’une atteinte du SNA central. Des POTS surviennent alors dans le cadre d’une atrophie multisystématisée ou d’une hypotension orthostatique idiopahique (34). Contrairement au SNA périphérique, l’implication des structures des voies centrales du SNA dans l’apparition de troubles dysautonomiques n’est bien individualisée que pour un nombre restreint d’affections. Atrophies multisystématisées Les atrophies multisystématisées (MSA) sont un groupe de maladies sporadiques responsables d’un syndrome extrapyramidal peu dopasensible, d’un syndrome cérébelleux et d’une atteinte dysautonomique (35). Cette dernière est due à une dénervation préganglionnaire. L’hypotension orthostatique est quasi constante (36). L’implication de certains médicaments donnés à visée symptomatique doit être recherchée dans le bilan étiologique de l’hypotension orthostatique (alphabloqueurs, sil dénafil, etc.). La présence de troubles génito-urinaires est typique. Chez les hommes, l’impuissance est très fréquente. La présence d’une incontinence urinaire récente avec vidange incomplète de la vessie est évocatrice du diagnostic. L’atteinte dysautonomique est typiquement plus marquée et progresse plus vite dans les MSA que dans la maladie de Parkinson. Maladie de Parkinson La différentiation entre une MSA et une maladie de Parkinson reste une difficulté pour le clinicien. En effet, la présence d’une atteinte dysautonomique est également classique dans la maladie de Parkinson. Elle est secondaire à une dénervation sympathique post ganglionnaire. Même si elle peut atteindre jusqu'à 50 % des pa tients, elle reste cependant le plus souvent modérée (36-37), bien qu’un sous-groupe de patients présente une hypotension orthostatique sévère qui peut faire craindre le diagnostic de MSA. L’imputabilité de la L-Dopa dans l’HO doit toujours être envisagée. Pourtant, une hypotension orthostatique comme seule manifestation de la dysautonomie rend peut probable la possibilité d’une MSA. L’hypotension orthostatique idiopathique L’hypotension orthostatique idiopathique ou pure autonomic failure est définie comme une hypo tension orthostatique isolée. Bien que parfois associée à d’autres troubles dysautonomiques comme l’anhidrose, elle ne s’accompagne d’aucune autre anomalie neurologique2. L’affection est assez rare et considérée comme dégénéra tive. Le pronostic à long terme semble meilleur que celui des MSA. La mise en évidence de corps de Lewy dans les ganglions sympa - thiques, parasympathiques, la substance noire, le locus coeruleus et les fibres nerveuses intra-épidermiques, ainsi que la synucléine alpha dans les ganglions sympathiques de patients atteints de PAF suggère que la maladie fasse partie du spectre de maladies associées à corps de Lewy avec de la synucléine alpha (Parkinson, maladies des corps de Lewy diffus et PAF) (38-39). Traumatisme crânien L’apparition d’une dysautonomie après un traumatisme crânien sévère est rare. Elle est de mauvais pronostic et semble corrélée à la présence de lésions axonales diffuses, une hypoxie avant l’admission et l’âge jeune du sujet. Elle associe hypertension, hyperthermie et tachypnée, avec parfois agitation et dystonie qui débutent en réanimation, mais peuvent se prolonger pendant des mois. Elle ne doit pas être méconnue, car elle peut mimer certaines pathologies intercurrentes comme un sepsis (40-41). Elle serait due à une dysfonction thalamique ou à une déconnexion du thalamus avec les structures corticales, sous-corticales et diencéphaliques du système nerveux autonome. L’apparition d’une dysautonomie après un traumatisme crânien sévère est rare et de mauvais pronostic. Traumatismes médullaires Des atteintes dysautonomiques paroxystiques sont rapportées chez les patients qui présentent des lésions médullaires au dessus de T6 (autonomic dysreflexia). La production de nerve growth factor (NGF) au niveau de la moelle lombosacrée entraîne une repousse axonale importante des fibres nociceptives pelviennes. Des poussées hypertensives, parfois sévères, peuvent alors être déclenchées par des stimuli nociceptifs comme un globe urinaire ou un fécalome. Elles sont dues à un relargage brutal et massif des neurones sympathiques prégan - glionnaires (42). Causes médicamenteuses pharmacologiques De nombreux médicaments interfèrent avec le système nerveux autonome. Citons les sympa thicomimétiques (imipramine, IMAO, etc.), les sympatholytiques (clonidine, barbituriques, alpha- ou bêtabloqueurs, etc.), les para sympathicomimétiques (anticholinestérasiques, pyridostigmine et néostigmine, parathion, etc.) et les parasympatholytiques (anticholinergiques, antidépresseurs tricycliques, phénothiazine, etc.) (43). Méthodes d’exploration Chez un patient suspect d’atteinte dysautonomique, diverses tech - niques permettent d’enregistrer le système cardiovasculaire, respiratoire, gastro-intestinal, génitourinaire, sudoripare ou pupillaire. Certaines sont routinières, voire réalisables au lit du patient, d’autres relèvent du domaine de la recherche. Le système cardiovasculaire est le plus facile d’accès en particulier grâce à l’utilisation de tests simples comme l’évaluation des variations du rythme cardiaque ou de l’hypotension orthostatique. Avant de débuter la procédure, le patient doit être allongé au repos pendant une vingtaine de minutes et doit être sevré des médicaments pouvant interférer avec les mesures. • Les principaux tests permettant d’évaluer le SNS sont : - la recherche d’hypotension orthostatique ; - la contraction musculaire contre résistance à 30 % de la force maximale pendant une minute doit conduire à une augmentation de la tension artérielle de 15 mmHg. • Les tests évaluant le SNPS : - l’épreuve de respiration ample. Les variations du rythme car diaque enregistrées en décubitus lors de la respiration ample con trôlée à 6 cycles/min pendant une minute, permet d’évaluer les modifications de l’espace RR. Normalement, le ratio entre la FC maximale (en inspiration) et la FC minimale (en expiration) doit être supérieur à 1,2 ; - la manoeuvre de Valsalva consiste à enregistrer les variations du rythme cardiaque par mesure de l’espace RR lors et au décours d’une exsufflation à 40 mmHg. Lors de la phase d’exsufflation, l’augmentation de la pression in trathoracique s’associe à une inhibition vagale avec bradycardie. Au décours de l’exsufflation, la stimulation vagale est responsable d’une tachycardie. Le rapport FC maxi male sur FC minimale doit être supérieur à 1,2. Les tests biologiques • Le dosage de la noradrénaline permet d’évaluer la voie efférente du SNS. Au repos, un taux de NA effondré peut être en relation avec une atteinte post ganglionnaire, alors qu’un taux normal ou élevé peut se rencontrer dans les atteintes préganglionnaires. En l’absence d’atteinte du SNS, le taux de NA doit augmenter de 50 % au minimum en orthostatisme. • L’étude du réflexe cutané sympathique évalue les variations de résistance des tissus cuta nés par un courant électrique stimulant des glandes sudoripares via l’activation des fibres C des nerfs sympathiques. Son utilisa tion en pratique clinique est limi tée en raison des grandes variabilités observées. • L’évaluation vésico-sphinctérienne est réalisée par un examen urodynamique en centre spécialisé. Il permet de préciser les mécanismes et les traitements à mettre en œuvre. • Les troubles de la mobilité gastrointestinale peuvent être évalués par un transit oesogastroduodénal. • L’évaluation des réflexes pupillaires avec le test des collyres est classiquement réalisée en ophtalmologie. Traitement Comme toujours le traitement est en premier lieu celui de la cause. Il sera adapté au cas par cas, mais peu de pathologies affectant le système nerveux autonome sont accessibles à un traitement per mettant de faire régresser les troubles. Il convient également d’éliminer les traitements ayant une action pharmacologique pouvant aggraver les symptômes. Le traitement est donc principalement symptomatique. Peu de pathologies affectant le système nerveux autonome sont accessibles à un traitement permettant de faire régresser les troubles. La prise en charge de l’hypotension orthostatique vise en premier lieu à supprimer les facteurs favorisants (déshydratation, anémie, hypotenseurs, médicaments associés). Des mesures générales peu vent s’appliquer (repas fragmentés, lever décomposé, évitement de l'orthostatisme prolongé, de l'al cool, des ambiances chaudes, ap ports hydriques suffisants, alimentation hypersodée, etc.). Si ces premières mesures sont insuffisantes le port de bas, voire de bandes de contention est recommandé. La midodrine (agoniste alpha-adrénergique) et la fludrocortisone (minéralocorticoïde hypokaliémiant) sont les deux médicaments de référence permettant de traiter les formes résistantes. D'autres médicaments sont réservés à des situations particulières. L’érythropoïétine pour certaines anémies et l’octréotide (analogue de la somatostatine) pour l’hypotension postprandiale. L'hypertension artérielle de décubitus est parfois une conséquence de ces traitements. Elle est prévenue par des règles simples : prise des médicaments vasoconstricteurs à distance du coucher et repos nocturne en position semi assise. Dans les cas les plus sévères, un traitement antihypertenseur doit être associé la nuit. Les atteintes dysautonomiques sont donc fréquentes, mais mal heureusement souvent méconnues ou négligées dans la prise en charge des patients. Leur retentissement sur la qualité de vie peut être très important. Leur authentification est donc primordiale pour une bonne prise en charge des patients.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :