Publié le 02 juil 2008Lecture 16 min
Une infection opportuniste à virus JC ou la leuco-encéphalopathie multifocale progressive
L. EL KHATTABI, O. PATEY, J. BREUIL, CHI Villeneuve-Saint-Georges
La leuco-encéphalopathie multifocale progressive (LEMP) est une pathologie démyélinisante rare, mais grave qui aboutit à des séquelles neurologiques irréversibles, responsables d’une issue fatale. Elle est due à un polyomavirus, le virus JC, qui détruit les oligodendrocytes, producteurs de myéline. La maladie survient après la réactivation du virus dans des contextes d’immunodépression profonde. La LEMP a été décrite initialement chez des patients atteints de lymphome, de leucémie myéloïde chronique et chez des allogreffés, mais on a assisté, au début des années 1980, à une augmentation très significative des cas corrélée à l’épidémie d’infection à VIH ; elle en est rapidement devenue l’une des principales infections opportunistes, à l’instar de la toxoplasmose ou des pneumocystoses, et la 1re complication nerveuse centrale. En 2005, trois cas de LEMP rapportés chez des patients traités par natalizumab ou rituximab (anticorps monoclonaux immunomodulateurs utilisés dans des maladies systémiques) ont relancé l’intérêt pour cette infection que l’on pensait confinée au cadre strict de quelques maladies immunodépressives. Cependant, si l’amélioration notable des connaissances de physiopathogénie et la mise au point de nombreuses molécules anti-virales ont permis d’élaborer quelques stratégies thérapeutiques nouvelles encore en cours d’investigation, aucun traitement spécifique réellement satisfaisant n’a fait la preuve d’une véritable efficacité à ce jour.
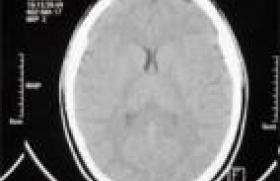
La leuco-encéphalopathie multifocale progressive (LEMP) est une infection mortelle du système nerveux central observée en cas d’immunodépression sévère. Elle demeure rare, mais son incidence, fortement liée à l’épidémie de VIH, pourrait augmenter si les thérapeutiques antirétrovirales actuelles étaient mises en échec dans les années à venir ; en outre, l’utilisation de traitements immunosuppresseurs modernes, plus puissants dans les affections systémiques, a récemment prouvé que le virus pouvait s’exprimer dans des contextes variés. La maladie est induite par la réactivation du virus JC qui va provoquer une démyélinisation, responsable d’une symptomatologie clinique assez polymorphe, accompagnée d’une dégradation rapide et irréversible après les premiers symptômes, d’où la nécessité d’un traitement étiologique précoce de la maladie causale chaque fois que possible. Le virus responsable La LEMP a été décrite pour la première fois en 1958 par K.E. Aström et coll. (1) à l’hôpital général du Massachusetts (États- Unis) chez deux patients suivis l’un pour leucémie lymphoïde chronique et l’autre pour maladie de Hodgkin. Il a fallu attendre 1965 pour mettre en évidence des particules virales par microscopie électronique dans des oligodendrocytes contenant des inclusions ; six ans plus tard, en 1971, le virus était isolé d’un prélèvement cérébral provenant d’un malade atteint de LEMP et nommé par les initiales du patient, dont le nom était John Cunningham. En 1984, l’ADN du virus était entièrement séquencé à l’Université de Pennsylvanie. Le virus JC (VJC) appartient au genre Polyomavirus de la famille des Papovaviridae. Parmi les polyomavirus, seuls les virus JC et BK se sont révélés pathogènes pour l’homme. Il s’agit de microorganismes mesurant 40 à 45 nm, non enveloppés, à ADN et capside icosaédrique. Le génome viral est bicaténaire, circulaire, torsadé et composé de 5 100 paires de bases. Il est associé à des histones cellulaires formant un nucléosome, de sorte que l'on a pu parler de minichromosome. Ce génome est divisé en une région de contrôle non codante contenant l’origine de la réplication et les promoteurs de la transcription, et deux régions codantes, une précoce « early » et une tardive « late ». Cinq protéines sont synthétisées pendant le cycle de réplication : les ARNm précoces codent pour 2 antigènes T dits « small T » et « large T » et les ARNm tardifs pour les protéines de capside VP1, 2 et 3 et une agnoprotéine (2). La réplication du DNA viral se fait par la DNA polymérase cellulaire. Il n’existe pas de DNA polymérase virale, d'où l'absence de possibilité d’une chimiothérapie antivirale comparable à celle qui existe pour les Herpesviridæ. Physiopathologie En l’absence d’un tableau clinique de primo-infection bien caractérisé, le mode de contamination par le virus JC reste mal connu. Une transmission salivaire et par les sécrétions oropharyngées est habituellement évoquée, mais des travaux récents effectués chez des sidéens et une population contrôle indiquent que le virus n’est pas toujours présent dans la sphère oropharyngée et que, même en cas de positivité, les titres en sont faibles (3). La primo-infection semble très souvent asymptomatique ou se résumerait à quelques signes bénins très peu spécifiques. Le virus persiste ensuite dans l’organisme de façon latente, localisé dans le tissu hépatique, les organes lymphoïdes et la moelle osseuse. Il se lie aux cellules par l’intermédiaire d’un récepteur sérotoninergique 5-HT2A trouvé sur les oligodendrocytes, les cellules gliales, les astrocytes, les hépatocytes et les lymphocytes B ; d’autres sites de quiescence existeraient, mais n’ont pas encore été mis en évidence. Dans un contexte d’immunodépression, l’agent viral est réactivé et disséminé au niveau du SNC, probablement par voie hématogène. En effet, les séquences virales retrouvées dans les tissus du SNC, au niveau sanguin et au niveau de la moelle osseuse montrent des répétitions en tandem dans la région de contrôle qui ne peuvent être mises en évidence dans les séquences issues du foie ou des urines. L’évolution vers la LEMP est liée à ces répétitions qui en présence des facteurs de transcription – notamment ceux de la famille des NFKB – sont à l’origine de la réplication de l’ADN viral. Dans un contexte d’immunodépression, l’agent viral est réactivé et disséminé au niveau du SNC. Chez l’immunocompétent et les sujets survivant à long terme à la LEMP, la réponse immunitaire est médiée en partie par l’immunité humorale, mais aussi et surtout par l’immunité cellulaire cytotoxique T4-dépendante : des lymphocytes T-CD8+ spécifiques anti-VP1p36 et VP1p100 ont été fréquemment mis en évidence chez ces deux populations, ce qui n’est pas le cas chez les patients décédés de la LEMP. Quant au mécanisme d’induction de l’apoptose des oligodendrocytes, il reste inexpliqué même si des études in vitro ont mis en évidence l’implication de l’agnoprotéine qui joue le rôle d’une petite protéine régulatrice indispensable au succès du cycle viral (4). Une épidémiologie en devenir Le réservoir des polyomavirus est strictement humain. Selon D. Walker et coll. (5), 10 % des enfants auraient séroconverti à 5 ans et entre 40 et 60 % à 10 ans. À l’âge adulte, au moins 75 % des individus seraient positifs, ce taux dépassant 90 % dans certaines zones urbaines. La primo-infection ne pourrait pas correspondre à la LEMP comme le montrent son extrême rareté chez l’enfant, l’absence d’IgM à ce stade et quelques cas d’isolements viraux des années avant l’apparition de la maladie. La prévalence des réactivations du JCV chez les sujets séropositifs au VIH au stade sida est estimée à environ 5 % et concerne notamment les sujets ayant moins de 100 CD4+/ml. Même si le virus est ubiquitaire, des études épidémiologiques ont montré une incidence de la LEMP plus basse en Inde et en Afrique qu’en Amérique ou en Europe. Il serait évidemment tentant de rapporter cette différence aux difficultés d’accès au diagnostic et au décès plus précoces des patients suite à d’autres infections opportunistes dans les pays en développement, mais il semblerait que des particularités génétiques au niveau de l’hôte, des souches du VIH et aussi du JCV puissent également jouer un rôle. La prévalence des réactivations du JCV au stade sida est estimée à environ 5 %. Les hémopathies malignes (ca : 13 % des cas) et les allogreffes (ca : 5 %) arrivent actuellement en deuxième position dans les étiologies de LEMP. Certains médicaments, comme les analogues puriques type fludarabine, semblent comporter un risque, évidemment lié au terrain, de développer une LEMP. En outre, des cas récents chez des patients traités par natalizumab pour une sclérose en plaques (SEP) ou une maladie de Crohn ont amené à s’interroger sur l’avenir de ces thérapeutiques qui avaient soulevé un grand espoir dans le traitement des maladies systémiques. Enfin, 2 % des femmes enceintes réactiveraient leurs infections à Polyomavirus (ou se ré-infecteraient ?), notamment à VJC. Ce phénomène a été mis en évidence par la détection de particules virales dans les urines de femmes enceintes, sans aucune manifestation clinique ni chez la mère ni chez le foetus. Aspects cliniques Les symptômes cliniques de la LEMP sont très polymorphes (3,6) et dépendent de la zone atteinte. L’état clinique du patient s’aggrave de façon progressive et continue jusqu’au décès. Classiquement, on retrouve des déficits moteurs, troubles cognitifs, dysarthrie et dysphasie, céphalées, perturbations de la démarche, atteintes du champ visuel et pertes de sensibilité. Contrairement à la SEP, le nerf optique et la moelle épinière sont épargnés. Quelques cas de diplopie ont été attribués à une atteinte des IIIe, IVe ou VIe nerfs crâniens. La LEMP n’affecte pas le système nerveux périphérique et aucun cas de myélopathie n’a été rapporté. De nouveaux aspects cliniques émergent, comme des formes inflammatoires avec une réponse immunitaire cellulaire massive à lymphocytes T CD8+ cytotoxiques, par exemple, dans le cadre d’un syndrome de reconstitution immunitaire à la suite de l’introduction d’une multithérapie antirétrovirale ou à l’arrêt du traitement immunosuppresseur à l’origine de la réactivation virale. En général, ces formes sont de bon pronostic d’où l’abstention de traiter par des corticoïdes s’il n’y a pas d’engagement cérébral. L’avènement des thérapeutiques anti-rétrovirales hautement actives de type HAART a fait passer le taux de survie de 10 à 50 % dans les trois premiers mois, et à 10 % à 1 an dans le cadre du sida, en procurant une certaine stabilisation des lésions. Cependant, la LEMP restera fatale tant qu’aucun traitement spécifique n’aura été élaboré, particulièrement lorsqu’elle survient sur un terrain autre que le VIH ou qui ne bénéficie pas d’un traitement aussi efficace. Diagnostic Imagerie : l’IRM d’abord Le scanner cérébral révèle des lésions hypodenses au niveau de la substance blanche sans effet de masse ni prise de contraste. L’IRM cérébrale est de loin plus sensible : les lésions, volontiers multiples et également limitées à la substance blanche, donnent un signal hyperintense en pondération T2 FLAIR et pas d’effet de masse ; en outre, on peut observer une fine prise de contraste péri-lésionnelle dans 5 à 10 % des cas (3). En théorie, ces images peuvent être retrouvées dans n’importe quelle région du cerveau ; mais en pratique, il s’agit plus fréquemment d’atteintes du lobe frontal et au niveau pariéto-occipital, probablement en relation avec leur volume. Les lésions observées peuvent être similaires à celles de la SEP. L’angiographie cérébrale n’est pas pratiquée en routine et n’est d’aucune valeur diagnostique particulière. Une amélioration des lésions à l’IRM semble être prédictive d’une bonne évolution clinique (7) (figure). Figure. L’IRM cérébrale est de loin l’examen le plus sensible aux lésions caractéristiques de la LEMP. Biologie : PCR et charge virale L’examen du liquide céphalorachidien est souvent prescrit afin de conforter le diagnostic et d’éliminer d’autres étiologies, surajoutées ou différentielles. Le comptage des éléments cellulaires rend des résultats typiquement inférieurs à 20 cellules/mm3 avec une médiane à 2/mm3 et une moyenne de 7,7/mm (3). La protéinorachie peut être légèrement élevée et la glycorachie abaissée, mais cette dernière reste le plus souvent dans les limites de la normale (3). La détection d’ADN viral dans le LCR est le meilleur moyen de diagnostic non invasif disponible. La technique est caractérisée par une sensibilité de l’ordre de 75 % et une spécificité de 96 %. La détection du génome du JCV dans le LCR constitue un élément présomptif, mais non formel de diagnostic, et sa détection dans les urines n’a aucune valeur, puisqu’une excrétion urinaire asymptomatique peut être observée aussi bien chez l’immunodéprimé que chez l’immunocompétent. Néanmoins, il est actuellement admis que le diagnostic de LEMP peut être retenu devant tout contexte clinico- radiologique évocateur, avec une PCR-JCV positive dans le LCR chez l’immunodéprimé. La détection d’ADN viral dans le LCR est le meilleur moyen de diagnostic non invasif disponible. La sérologie, positive pour une grande majorité de la population, ne présente aucun intérêt dans la mise en évidence d’une infection active. Une technique quantitative permettant de déterminer la charge virale a été mise au point. Elle semble avoir une certaine valeur pronostique bien qu’elle ne soit pas corrélée au volume des lésions cérébrales. Un autre examen à valeur pronostique, en cours de développement, est la détection de lymphocytes T cytotoxiques spécifiques du virus : ces cellules immunitaires, probablement responsables de la destruction des oligodendrocytes infectés, préviendraient la progression de l’infection et détermineraient la valeur de la charge virale. Histologie : toujours la référence Le diagnostic de référence reste histologique. Il est caractérisé par une triade qui comprend une démyélinisation multifocale, des oligodendrocytes à noyau volumineux et hyperchromatiques avec des inclusions basophiles, et des astrocytes « atypiques» à noyau hyperchromatique et lobé. La démyélinisation est le caractère fondamental, visible macroscopiquement et microscopiquement. Dans de rares cas, le foyer de démyélinisation peut être unique, mais en général le processus initial est multifocal, suivi d’une fusion des petites lésions. La taille des lésions varie d’un millimètre à plusieurs centimètres. Une détection du VJC à l’intérieur des oligodendrocytes peut être réalisée par des techniques d’hybridation in situ ou par immuno-histochimie. Cet examen, qui nécessite de réaliser une biopsie cérébrale, a été quasiment abandonné avec l’avènement des techniques de biologie moléculaire couplées à l’IRM. Lors d’un syndrome de reconstitution immunitaire, la biopsie révèle une réaction inflammatoire avec une infiltration par des monocytes et des macrophages. Le caractère invasif de cet examen le fait réserver aux patients chez qui le diagnostic de LEMP reste probable malgré une PCRJCV négative dans le LCR. Traitements : de grands bouleversements en perspective Les essais thérapeutiques menés à ce jour se sont soldés par de véritables déceptions, et l’évolution des connaissances de physiopathologie concernant le JCV n’a pas encore permis de mettre au point un traitement spécifique de la LEMP. L’instauration des multithérapies antirétrovirales a amélioré la survie des patients VIH + concernés, mais le pronostic reste très réservé puisque l’infection continue d’être mortelle une fois sur deux dans les 6 mois suivant l’apparition des premiers symptômes ; de plus, le bénéfice des thérapeutiques anti-rétrovirales n’a pas été observé dans toutes les études et les résultats semblent meilleurs chez les patients naïfs d’antirétroviraux. Enfin, les lésions cérébrales constituées étant irréversibles, ce léger bénéfice ne s’accompagne généralement pas d’une amélioration des fonctions neurologiques. La recherche d’alternatives thérapeutiques, en particulier pour les patients non VIH pour lesquels on reste très dépourvus, a conduit à élaborer différents essais. Un premier espoir était la cytarabine qui possède une action démontrée in vitro, mais la molécule s’est révélée décevante in vivo, sans doute parce qu’elle se diffuse mal dans le tissu cérébral. Les dérivés de la camptothécine, inhibiteurs de la topo-isomérase I, ont eux aussi connu le même sort, parce que trop toxiques. Le cidofovir enfin, un analogue nucléotidique actif contre différents virus à ADN, s’est révélé inefficace tant en termes de survie qu’en termes fonctionnels lors d’une métaanalyse internationale6. Une meilleure compréhension des interactions entre le JCV et la cellule hôte ouvre de nouvelles perspectives. Une proposition thérapeutique très prometteuse pourrait résider dans l’utilisation des antagonistes des récepteurs sérotoninergiques HT2A, déjà utilisés en psychiatrie comme neuroleptiques. Ces médicaments, doués d’une bonne diffusion intracérébrale, seraient capables d’empêcher la pénétration intracellulaire du virus via ces récepteurs ; il importe cependant de rester prudent tant que les résultats d’une large étude en cours ne seront pas publiés, d’autant qu’un cas d’échec au traitement par chlorpromazine et cidofovir a été rapporté récemment (9). Une proposition thérapeutique très prometteuse pourrait résider dans l’utilisation des antagonistes des récepteurs sérotoninergiques HT2A. D’autres voies sont explorées, comme l’utilisation de petits ARN interférents spécifiques, efficaces in vitro et simples à produire, mais dont aucune application médicale n’est envisageable dans l’immédiat, puisque l’on ne dispose encore d’aucune donnée de pharmacocinétique, de pharmacodynamie, de sécurité ni d’efficacité. Une autre voie, enfin, est celle de l’immunothérapie, avec pour but d’augmenter la réponse cytotoxique spécifique contre le JCV, par exemple en transférant des lymphocytes T auxiliaires et cytotoxiques spécifiques, autologues ou hétérologues. En pratique Le virus JC apparaît aujourd’hui comme un pathogène important alors que les connaissances à son sujet restent parcellaires dans plusieurs domaines, comme en physiopathologie ou en épidémiologie où les conditions de sa transmission ne sont pas parfaitement élucidées. La LEMP, qui représente une phase de réactivation tardive du virus, reste de pronostic très péjoratif et n’admet pour le moment aucune thérapeutique éradicatrice qui ait fait ses preuves ; il s’agit pourtant d’une étape qu’il faudra franchir rapidement, sous peine de devoir retarder, voire arrêter, le développement des nouvelles thérapeutiques immunomodulatrices des maladies de système comme le rituximab ou le natalizumab, anticorps monoclonaux d’immuno-intervention d’avenir.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :