Publié le 12 nov 2008Lecture 9 min
Une cruralgie en cours de grossesse
G. AYOUB, J.-D. LAREDO, Hôpital Lariboisière, Paris
L'histoire est celle d’une femme de 33 ans, au cinquième mois d’une première grossesse, jusque-là sans incident. Elle se plaint de douleurs de la face antérieure de la hanche gauche, d’installation insidieuse, et d’horaire mécanique. L’interrogatoire ne révèle pas d’antécédents notables, notamment pas de notion de traumatisme ou de faux mouvement. L’examen clinique ne retrouve pas de syndrome rachidien, et l’examen neurologique des membres inférieurs est sans particularités. Le diagnostic de cruralgie commune est finalement retenu, et la patiente est mise sous antalgiques avec une efficacité partielle.
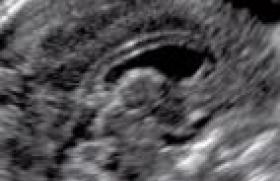
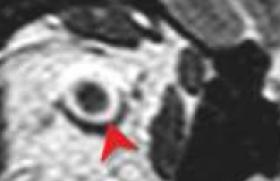
La grossesse est menée à terme, et l’accouchement se déroule normalement, mais la patiente note une exacerbation de ses symptômes en postpartum. Les douleurs ne sont plus strictement mécaniques, puisque désormais elles sont le plus marquées au réveil. Les AINS semblent plus efficaces que les antalgiques simples. L’examen clinique est toujours normal, exception faite d’un syndrome clinostatique qui n’existait pas auparavant. Des radiographies standards du rachis lombaire et du bassin sont alors demandées, mais aucune anomalie n’y est décelée. Le scanner du bassin révèle la présence d’une image lytique du toit et de la colonne antérieure du cotyle gauche avec une extension en avant, dans les tissus mous (figures 1 à 4). Figure 1. Coupe scannographique coronale montrant une image lytique du cotyle gauche. Figure 2. Autre coupe scannographique coronale montrant une corticale soufflée avec une extension dans les parties molles adjacentes. Figure 3. Coupe scannographique frontale montrant la lésion lytique du toit du cotyle gauche, avec un amincissement de la corticale osseuse. L’IRM, sans injection de produit de contraste, montre la présence de niveaux liquidiens (figures 5 à 7). Figure 4. Autre coupe scannographique frontale montrant l’aspect cloisonné de la lésion. Figure 6. IRM T2 coupe frontale montrant la lésion en hypersignal liquidien. Figure 5. IRM T1 coupe frontale montrant la lésion du cotyle gauche en isosignal musculaire. Figure 7. IRM T2 coupe coronale montrant la présence d’un niveau liquidien à l’intérieur de la lésion. Figure 8. IRM de contrôle 1 mois et demi plus tard, coupe frontale T1, montrant une augmentation de taille de la lésion, toujours en isosignal musculaire. Figure 9. IRM de contrôle, coupe frontale T2, montrant la présence de nombreuses cavités liquidiennes, de petite taille, toujours en hypersignal. L’IRM de contrôle, faite un mois et demi plus tard, montre une augmentation de taille de la lésion, avec des logettes plus nombreuses, et la présence d’une partie charnue sur le bord antérieur de la lésion (figures 8 à 11). Une biopsie sous scanner est alors décidée. Figure 10. IRM T2 coupe coronale montrant la lésion avec des logettes en hypersignal hétérogène avec des niveaux séro-hématiques et une partie charnue antérieure. Figure 11. IRM T1 Gado montrant une prise de contraste de la paroi des cavités kystiques. Les nouvelles coupes scannographiques montrent l’apparition d’une coque périostée calcifiée autour de la lésion (figures 12 et 13), très en faveur d’un kyste osseux anévrysmal dont le diagnostic sera finalement confirmé par les prélèvements histologiques. Figure 12. Coupe scannographique avant la biopsie, montrant l’apparition d’une coque périostée. Figure 13. Agrandissement montrant bien l’aspect scannographique de la coque périostée. Commentaires Le kyste osseux anévrysmal est une lésion osseuse bénigne faite de cavités remplies de sang. Il représente près de 1 % des tumeurs osseuses bénignes. Il touche les sujets de moins de 20 ans dans 80 % des cas, avec une légère prépondérance féminine. Il est primitif dans près de 70 % des cas, dans les 30 % restants, ils se développent sur une lésion préexistante, plus souvent bénigne que maligne, notamment une tumeur à cellules géantes, un chondroblastome, une dysplasie fibreuse des os, un ostéoblastome, un fibrome non ossifiant, un fibrome chondromyxoïde, et plus exceptionnellement un sarcome osseux. La pathogénie reste controversée et plusieurs théories ont déjà été avancées dont : un déséquilibre hémodynamique qui serait à l’origine de la lésion osseuse, par augmentation de la pression veineuse responsable d’une dilatation capillaire (malformation artério-veineuse ou thrombose veineuse) ; une origine traumatique du fait de l’hyperhémie et de l’altération du flux vasculaire existant pendant la phase de consolidation de la fracture. On notera d’ailleurs qu’un antécédent traumatique n’est retrouvé que dans près de 50 % des cas ; une perturbation vasculaire, elle-même secondaire à un autre désordre osseux, à type de tumeur osseuse, bénigne ou maligne ; une réparation tissulaire suite à une hémorragie locale, et où le tissu ostéolytique entretient l’hémorragie ; une origine héréditaire. La localisation préférentielle du kyste osseux anévrysmal est la métaphyse des os longs, notamment sur le fémur (22 % des cas), le tibia (17 %), l’humérus (10 %) ou la fibula (9 %). D’autres localisations sont possibles au rachis, en particulier dorsal, et surtout à l’arc postérieur, avec une possibilité d’extension aux corps vertébraux adjacents (15 %), ou au pelvis, au voisinage du cartilage en Y de l’acétabulum (9 %). Cliniquement, le kyste anévrysmal peut se manifester par des douleurs ou une tuméfaction locale, et selon la localisation, par une fracture pathologique, des signes neurologiques, ou une limitation de l’amplitude articulaire. Les localisations au rachis peuvent se manifester par un torticolis ou une scoliose douloureuse. L’histologie montre une lésion expansive, faite d’espaces caverneux anastomosés, contenant du sang non cailloté, avec des parois kystiques bordées de fibroblastes et de cellules géantes multinucléées de type ostéoclastique, et des septas fibreux d’épaisseur variable, pouvant contenir du tissu ostéoïde ou des cellules géantes. À noter qu’il n’existe pas de tissu élastique, de cellules endothéliales, ou de cellules musculaires comme dans la paroi vasculaire. Du point de vue évolutif, on distingue le kyste osseux anévrysmal agressif, avec une ostéolyse uniforme sans limites visibles, le kyste actif, avec ossification souspériostée discontinue, et le kyste inactif, qui est bien limité en profondeur par une sclérose, et en superficie par une ossification sous-périostée continue. Les radiographies standards et la tomodensitométrie montrent une image lytique métaphysaire, polylobée avec des cloisons, excentrée, à limites nettes, parfois floues, et pouvant s’accompagner de sclérose périphérique ou de trabéculations internes. La corticale est souvent soufflée, amincie, parfois absente. Le kyste peut augmenter rapidement de volume, avec une extension dans les tissus mous. La lésion peut franchir le cartilage de conjugaison et les localisations épiphysaires sont possibles. Le kyste est alors secondaire dans près de 70 % des cas, essentiellement à une tumeur à cellules géantes. L’aspect radiologique passe par 3 phases : pseudomaligne avec ostéolyse et masse des parties molles, phase d’état avec apparition d’une coque périostée, et phase de réparation. La coque périostée est vue plus précocément au scanner. L’IRM montre une masse multilobulée composée des cavités liquidiennes en hyposignal T1 et en hypersignal T2, ainsi que des niveaux liquidiens témoignant du contenu hémorragique. Les logettes sont habituellement délimitées par des septas fibreux, rehaussés par le produit de contraste. On constate souvent une délimitation nette avec les tissus mous par un liseré périphérique en hyposignal T1 et T2, avec prise de contraste. Le diagnostic de kyste anévrysmal primitif est d’autant plus probable que la lésion est composée uniquement de cavités hématiques juxtaposées. La présence d’un composant solide peut correspondre à une tumeur associée (kyste anévrysmal secondaire), à un composant de kyste anévrysmal dit solide et heureusement assez exceptionnellement à un ostéosarcome télangiectasique simulant un kyste anévrysmal. C’est sur cette composante solide que doit porter la biopsie. Les kystes solides ont un aspect non spécifique, avec un isosignal musculaire en T1, un signal hétérogène en T2, et une prise de contraste plus ou moins homogène. Dans les kystes en voie de guérison, on note une régression des plages de contenu kystique, et l’apparition de tissu graisseux dans la lésion. La scintigraphie montre une hyperactivité périphérique et une hypoactivité centrale, mais cet aspect est inconstant, puisque observé dans 40 à 65 % des cas, et non spécifique, puisque présent dans la tumeur à cellules géantes et le chondrosarcome. La biopsie reste indispensable au diagnostic, l’imagerie ne posant qu’un diagnostic de probabilité. Elle permet de rechercher une tumeur associée au kyste anévrysmal (kyste anévrysmal secondaire) et d’écarter un exceptionnel ostéosarcome télangiectasique. Dans certains cas, la biopsie peut guérirles kystes anévrysmaux primitifs par un phénomène de thrombose et de fibrose. D’autres lésions avec des niveaux liquidiens rentrent dans le diagnostic différentiel du kyste osseux anévrysmal : le chondroblastome, la tumeur à cellules géantes, le kyste essentiel fracturé, l’hémangiome osseux, la dysplasie fibreuse des os, ou l’ostéosarcome télangiectasique. Traitement Différentes modalités thérapeutiques existent. Elles font appel : à l’abstention thérapeutique ; à une embolisation artérielle sélective, seule ou en préopératoire ; à un curetage et une excision de la paroi du kyste, plus ou moins associée à une greffe osseuse ou une ostéosynthèse (10 à 20 % de récidives) ; à une résection chirurgicale large accompagnée ou non d’une greffe osseuse, donnant peu de récidives ; à l’injection percutanée d’Ethibloc ® ayant des propriétés sclérosantes, ou d’alcool visant à obtenir une oblitération des artérioles pariétales du kyste. Cette modalité est encore réservée aux localisations chirurgicalement difficiles d’accès et aux récidives ; ou à l’implantation de particules osseuses partiellement déminéralisées associées à de la moelle autologue, et ayant un effet ostéogénique. Les indications thérapeutiques sont : pour un kyste inactif, une surveillance avec abstention thérapeutique. Souvent la guérison est obtenue après la biopsie ; pour les kystes actifs ou agressifs, une résection ou un curetage en fonction de la localisation ; pour les localisations difficilement accessibles à la chirurgie, une embolisation ou une injection d’Ethibloc®. Dans le cas présenté, plusieurs injections d’Ethibloc® et d’alcool ont permis d’obtenir une régression des douleurs et un début de réparation. On notera que les récidives sont précoces, souvent dans les 2 ans suivant le traitement.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :