Publié le 11 fév 2008Lecture 16 min
Traitement endovasculaire des anévrismes intracrâniens
S. GALLAS, Service de neuroradiologie diagnostique et thérapeutique, Hôpital Maison-Blanche, Reims

Les anévrismes intracérébraux sont responsables d’hémorragie méningée, maladie très grave dont la mortalité est élevée. Le traitement de référence a longtemps été chirurgical avec la mise en place d’un clip sur l’anévrisme. Depuis l’apparition de spires à détachement contrôlé ou coils, le traitement endovasculaire s’est considérablement développé pour tous les types d’anévrismes. En France, 80 à 85 % de tous les anévrismes sont actuellement traités par voie endovasculaire.
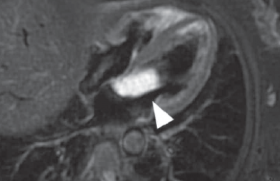
Cause majeure des hémorragies sous-arachnoïdiennes, les anévrismes se définissent comme une ectasie localisée de la paroi artérielle, siégeant le plus souvent au niveau du polygone de Willis. La classification des anévrismes intracrâniens est basée sur leur morphologie, leur taille, leur location et leur étiologie. La majorité des anévrismes intracrâniens sont de « vrais » anévrismes contenant tous les composants de la paroi d’un vaisseau. Au contraire, les faux anévrismes ou pseudo-anévrismes n’ont pas la même histologie. Les anévrismes intracrâniens sont divisés en trois catégories : - forme sacculaire, la plus classique avec un sac anévrismal et le collet qui est la région de jonction entre l’anévrisme et le sac ; - forme fusiforme qui correspond à un élargissement bilatéral des deux parois artérielles ; - forme dissécante, associée à un clivage de la paroi vasculaire. Ils peuvent être uniques dans 70 à 75 % des cas ou bien multiples dans 25 à 30 % des cas. La localisation de ces anévrismes sur le polygone de Willis se fait majoritairement sur le segment antérieur pour 85 % d’entre eux (communicante antérieure, artère cérébrale moyenne, terminaison de carotide, carotido-ophtalmique, rétrocarotidien) et, dans 15 % des cas, sur le segment postérieur (artère vertébro-basilaire). La physiopathologie de l’apparition des anévrismes n’est pas très bien connue actuellement : on sait que des facteurs endogènes comme l’hypertension artérielle, certaines variétés du polygone de Willis ou des modifications de flux au niveau cérébral peuvent concourir à la formation des anévrismes. De même certains facteurs exogènes interviennent telle la consommation de tabac ou d’alcool. Il existe des formes familiales d’anévrismes, dont l’incidence serait de 5 %. Les maladies du tissu élastique sont aussi associées à une plus grande fréquence d’anévrismes, c’est le cas pour les maladies d’Ehlers-Danlos, les anomalies dermatologiques de type cutis laxa, les patients atteints de polykystose rénale. Sans qu’on sache exactement à partir de quelle taille un anévrisme cérébral est susceptible de se rompre, il est actuellement admis qu’un traitement préventif est justifié. L’utilisation des techniques endovasculaires dans la prise en charge des anévrismes intracrâniens est acceptée et incontestée, notamment pour les anévrismes rompus, depuis les résultats de l’étude ISAT (1). Cette étude prospective, randomisée, a démontré la supériorité du traitement endovasculaire par rapport au traitement chirurgical concernant les anévrismes rompus avec une diminution de 7,6 % de la morbi-mortalité pour le traitement endovasculaire comparativement à la chirurgie. Pour les anévrismes non rompus, l’étude ISUIA (2) a démontré un taux de saignement de 0,05 % pour les petits anévrismes et de 1 % pour ceux de plus de 10 mm, avec un risque accru pour les patients ayant déjà saigné. Pour S. Juvela et coll. (3), le taux annuel de rupture est de 1,3 % par an. Ces différentes séries rapportent toutes une mortalité supérieure à 50 % en cas de rupture anévrismale. Sans qu’on sache exactement à partir de quelle taille un anévrisme cérébral est susceptible de se rompre, il est actuellement admis qu’un traitement préventif est justifié. La détection des anévrismes Le diagnostic d’hémorragie sous-arachnoïdienne repose essentiellement sur les données cliniques. Une hémorragie méningée se traduit toujours par la survenue brutale d’une céphalée violente, d’installation rapide, en coup de fusil, avec, à l’interrogatoire, aucun élément en faveur d’une crise de migraine ou de sinusite. Il s’y associe fréquemment une photophobie, une raideur de nuque. La présentation clinique peut être variable allant de céphalées mineures réalisant « l’epistaxis méningée » au coma profond, avec l’atteinte d’emblée des fonctions vitales. La survenue d’une hémiplégie ou de troubles déficitaires neurologiques témoigne le plus souvent d’un hématome intracérébral associé à l’hémorragie sous-arachnoïdienne. Une crise convulsive peut être inaugurale dans 5 % des cas. L’exploration tomodensitométrique doit être l’exploration de première intention. L’exploration tomodensitométrique doit être l’exploration de première intention, d’abord sans injection pour confirmer le diagnostic d’hémorragie, puis à la recherche des complications immédiates (hématome avec effet de masse, hydrocéphalie, engagement cérébral, hémorragie intraventriculaire). Depuis l’apparition des scanners multibarrettes, il est maintenant possible de réaliser en moins d’une minute un angioscanner permettant de visualiser tout le polygone de Willis et mettant en évidence l’anévrisme, même quand celui-ci est de petite taille. L’utilisation des séquences d’angiographie à l’IRM permet la mise en évidence des anévrismes, grâce notamment aux séquences 3D TOF (time of flight). Les anévrismes sont visualisés sur ces séquences d’angiographie par résonance magnétique (angio-MR) dès que leur taille dépasse 3 mm. Avec l’apparition des nouvelles IRM à haut champ, (3 Teslas), les performances sont encore plus significatives grâce à l’amélioration du rapport signal sur bruit et de la résolution des images. Cette technique d’imagerie est aussi beaucoup utilisée pour le suivi des anévrismes après leur traitement par technique endovasculaire. Angiographie cérébrale, opacification de l’artère carotide interne droite. Anévrisme de l’artère communicante antérieure avant traitement, vue de face (A). Contrôle final après embolisation. L’anévrisme de l’artère communicante antérieure est occlus (B). De la chirurgie à l’embolisation par spirale (coil) à détachement contrôlé Le but premier de la prise en charge des anévrismes intracrâniens est la prévention de leur rupture. La prise en charge chirurgicale a été le traitement de référence depuis des années permettant d’exclure l’anévrisme de la circulation vasculaire. Le traitement endovasculaire a d’abord consisté à mettre en place un ballonnet largable en amont de l’anévrisme, pour une occlusion non sélective de l’artère porteuse. Puis les ballonnets ont été utilisés pour l’occlusion du sac anévrismal lui-même, en respectant l’intégrité de l’artère porteuse de la malformation. Depuis l’apparition des coils (spires) à détachement contrôlé, en 1991, (4,5) l’embolisation est devenue le traitement classique des anévrismes. L’utilisation de ces coils introduits dans le sac anévrismal par l’intermédiaire d’un microcathéter apporte une sécurité et une efficacité, telles que ce traitement a transformé les indications thérapeutiques. Depuis l’apparition des coils (spires) à détachement contrôlé, l’embolisation est devenue le traitement classique des anévrismes. La technique d’embolisation Le patient est sous anesthésie générale. Après une ponction fémorale pour mise en place d’un introducteur à valves anti-reflux, une sonde dite « porteuse » est placée dans l’artère où se situe l’anévrisme ; puis un microcathéter est lui-même dirigé sous contrôle scopique dans le sac anévrismal à l’aide d’un micro-guide. Une fois en place, quand le sac anévrismal est cathétérisé, on déroule des coils de différentes tailles pour remplir cet anévrisme. Les coils sont choisis en fonction de la morphologie de l’anévrisme, de la taille du sac et de la taille du collet. Ces dimensions sont maintenant obtenues par les logiciels de reconstruction 3D qui nous permettent de bien visualiser l’anévrisme, sa morphologie et ses rapports avec les vaisseaux porteurs. Cette intervention nécessite la mise en place d’une anticoagulation pour éviter tout phénomène ischémique induit par l’utilisation de sondes et de matériels étrangers dans le système vasculaire. Cathétérisation de l’anévrisme à l’aide du microcathéter (A). Une fois en place, le premier “coil” est déployé au sein de l’anévrisme (B). En fin d’embolisation, l’anévrisme est rempli par la masse des coils (C). Les différents types de coils Il existe actuellement différents types de coils depuis l’apparition des premières spires à détachement contrôlé. On peut ainsi les classer par leur technique de détachement : - les coils à détachement électrique : le détachement va s’effectuer par un mécanisme d’électrolyse induit par un courant électrique continu à l’extrémité distale du coil. - Les coils à détachement mécanique : c’est le plus souvent par un mécanisme de pression hydraulique en distalité que le coil se sépare de son guide pousseur. - Plus récemment sont apparus des coils, dont la spire en platine est recouverte de filaments de molécules (type PGLA), qui favorisent la thrombose au sein de l’anévrisme et permettent une meilleure occlusion du sac anévrismal. Les coils se distinguent également entre eux selon leur forme, certains se déroulent tout simplement en spires de même diamètre, d’autres ont un déploiement en 3D formant une sphère et permettant de créer une bonne « cage » au sein de l’anévrisme. En ce qui concerne l’épaisseur de la spire, il existe actuellement deux diamètres : coils en 10 ou 18. La technique de remodeling Lorsque l’anévrisme a une forme irrégulière avec un collet assez large, les spires peuvent glisser hors du sac anévrismal du fait de cette géométrie irrégulière. Une technique (dite de remodeling) a alors été développée (6,7) permettant de stabiliser ces coils dans le sac anévrismal lors du déploiement : il s’agit d’amener en face du collet anévrismal un petit ballon qui sera gonflé lors du déroulement du coil pour faciliter sa mise en place. Une fois que le coil est bien « roulé » dans l’anévrisme, le ballon est dégonflé puis retiré de l’artère. Cette occlusion partielle et momentanée du vaisseau porteur permet au coil de se stabiliser dans le sac anévrismal. Cette technique, un peu plus compliquée que le traitement classique nécessite la mise en place de deux microcathéters dans le vaisseau porteur. Cependant, cette manipulation, par des médecins expérimentés, n’entraîne pas plus de complications. La technique de stenting Pour ces anévrismes de forme irrégulière, une autre alternative thérapeutique est l’utilisation d’un stent intracrânien. Dans un premier temps, on place le microcathéter d’embolisation dans l’anévrisme avant de déployer le stent. Cette technique présente l’avantage de ne pas avoir à traverser les mailles du stent avec le microcathéter pour emboliser l’anévrisme. Cette utilisation d’un « corps étranger » entraîne des risques de thrombose accrue par rapport à une embolisation simple, il faut donc maîtriser ce phénomène en préparant l’organisme par un traitement médicamenteux. Les protocoles actuels sont d’instituer en préventif un traitement associant aspirine 150 g/j et 75 mg/j de clopidogrel ; puis après l’intervention, 75 mg/j de clopidrogel avec 100 mg/j d’aspirine pendant trois mois. La nécessité de cette double anticoagulation représente une contre-indication relative à l’utilisation de stent en urgence chez un patient ayant fait une hémorragie méningée. Plusieurs types de complications lors de l’embolisation Le traitement endovasculaire est potentiellement associé à la survenue de complications dues au traitement lui-même (8-13). Le taux de morbidité procédurale est évalué entre 3,7 et 10 % selon les études et 0 à 2,1 % pour la mortalité. La thrombose d’un vaisseau pendant la navigation endovasculaire ou du vaisseau porteur de l’anévrisme peut provoquer une ischémie. Tout matériel étranger introduit dans le système vasculaire est potentiellement thrombogène, d’où la nécessité absolue de réaliser cette procédure sous anticoagulation efficace. Il peut aussi s’agir de la migration d’un embol lors de la cathéthérisation de l’anévrisme ou bien de la migration du matériel d’embolisation. Des études récentes ont démontré que tous les événements thromboemboliques n’étaient pas responsables de signes cliniques : A.I. Qureshi et coll.13 rapportent un taux de complications thromboemboliques de 8,2 % postprocédure, avec des déficits neurologiques chez 5,4 % de leurs patients. La gravité de ces complications dépend aussi du territoire vasculaire atteint. La rupture de l’anévrisme peut se produire pendant le traitement : en effet, la manipulation du microcathéter et du microguide dans un anévrisme qui vient de saigner est délicate ; les parois de l’anévrisme sont très fragiles et le déploiement du premier coil peut être responsable d’un nouveau saignement. Les conséquences sont variables : dramatiques quand elles se traduisent par une hémorragie méningée massive, avec hématome ou hémorragie intraventriculaire (mortalité accrue) ou, à l’inverse, peu notables quand il s’agit d’une simple extravasation de produit de contraste en sous-arachnoïdien. Cette complication est la plus redoutée, car non prévisible et possible même dans des mains très expérimentées. La seule conduite à tenir est de continuer à remplir l’anévrisme à l’aide de coils pour freiner ce saignement actif. Angiographie de l’artère vertébrale gauche, vue de face. Anévrisme du sommet du tronc basilaire (A). Contrôle final après traitement, vue de face (B). Les complications de l’hémorragie méningée elle-même Après une hémorragie méningée, les patients sont hospitalisés en soins intensifs pour une surveillance clinique et hémodynamique. Le traitement anticoagulant est maintenu au moins cinq jours. Après traitement, le danger est lié à la survenue de complications secondaires à l’hémorragie méningée que sont l’hydrocéphalie et le vasospasme. L’hydrocéphalie peut se voir de façon aiguë, dans les 24 premières heures après l’hémorragie, du fait de la présence de sang au niveau ventriculaire et dans les citernes de la base, entraînant une obstruction du système ventriculaire et une augmentation de la pression intraventriculaire. Le traitement idéal de l’hydrocéphalie est la mise en place d’un drainage externe du LCR par les neurochirurgiens. L’hydrocéphalie peut aussi se développer dans les semaines suivant l’épisode initial. Dans ces cas, l’indication d’un drainage ventriculopéritonéal est discutée. Dans certaines équipes, le drainage du LCR est fait précocement (avant le traitement endovasculaire et la mise sous héparine), dès que les signes précoces d’hydrocéphalie apparaissent au scanner, évitant un geste chirurgical sous anticoagulation. Le vasospasme est la complication la moins prévisible de l’hémorragie méningée et la plus grave. C’est une des causes majeures de morbidité et de mortalité dans ce contexte. Ce vasospame se développe entre le 7e et le 13e jour après l’hémorragie initiale. Son mécanisme physiopathologique n’est pas encore très bien compris. Il se détecte à l’examen Doppler pulsé des artères cérébrales ou bien à l’angiographie. Cliniquement, il faut l’évoquer quand un patient qui allait bien se détériore et présente des signes neurologiques, des déficits moteurs ou sensitifs, ou une confusion. Le meilleur traitement repose sur l’utilisation de vasodilatateurs type nimodipine en perfusion de façon systématique chez tout patient qui a saigné et en préventif, associé au maintien d’une bonne tension de perfusion cérébrale et à une hyperhydratation. En général, le vaisseau porteur de la malformation vasculaire est le premier à se spasmer, mais très vite le vasospasme devient diffus et touche les différents territoires vasculaires. Il va entraîner dans les cas les plus graves une ischémie cérébrale par défaut de perfusion. Cette ischémie est responsable d’un œdème cérébral cytotoxique, majorant alors la pression intracrânienne, ce qui diminue encore la perfusion cérébrale. Ce cercle vicieux est responsable d’un œdème cérébral massif puis d’un engagement cérébral conduisant au décès. Dans ces cas dramatiques, un traitement endovasculaire peut être envisagé : perfusion in situ de vasodilatateur et angioplastie mécanique in situ à l’aide de ballonnets gonflables. Certains protocoles de neuroanesthésie utilisent la perfusion intrathécale de sulfate de magnésium, améliorant la symptomatologie des patients. Seulement 5 % des patients traités devront avoir une autre embolisation. Quelle surveillance pour les anévrismes embolisés ? Tous les patients traités par embolisation par coils doivent être suivis très régulièrement (14,15) : il faut détecter rapidement tout signe de recanalisation par tassement des coils ou par « repousse » de l’anévrisme. La première année après le geste, les patients bénéficient d’un contrôle par artériographie cérébrale et par angio-MR. Selon les services, le suivi ultérieur associe artériographie et IRM tous les ans ou bien simplement une angio-MR. Les premières études publiées sur le suivi des anévrismes embolisés font état d’un taux de recanalisation entre 5 et 15 %, selon les différents critères d’évaluation utilisés. Le taux de retraitement est évalué à 5 %, c’est-à-dire que seulement 5 % des patients traités devront avoir une autre embolisation pour venir compléter une embolisation incomplète. Très peu de cas de rerupture ont été décrits dans la littérature, mais actuellement le recul sur ce traitement est encore faible. Ces notions de retraitement et de repousse anévrismale sont identiques pour les anévrismes rompus comme non rompus. En pratique Le traitement endovasculaire, depuis l’apparition des coils à détachement contrôlé, a considérablement modifié la prise en charge des patients porteurs d’anévrisme. Les différentes études ont montré l’avantage de cette prise en charge pour les anévrismes rompus et d’autres études sont actuellement en cours pour les anévrismes non rompus. Les complications du traitement endovasculaire sont la perforation anévrismale et tous les risques ischémiques dus à la navigation endovasculaire et la manipulation de matériel. Le suivi à moyen terme est tout à fait rassurant montrant une stabilité des occlusions, avec seulement 5 % de retraitement.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :