Publié le 06 déc 2009Lecture 11 min
Les « impatiences » ou le syndrome des jambes sans repos : diagnostic et conduite à tenir
P. ESCOURROU, Centre de Médecine du Sommeil, Réseau Morphée, Hôpital Béclère, Clamart
Le syndrome des jambes sans repos est un besoin impérieux de bouger les membres inférieurs, associé à des dysesthésies. Les symptômes ont une rythmicité circadienne et une prédominance vespérale, entraînant des troubles d’endormissement. Ce syndrome doit être différencié des algies vasculaires : artérite ou troubles veineux. Il s’accompagne souvent de mouvements périodiques des jambes pendant le sommeil, non perçus par le patient, mais responsables d’une fragmentation du sommeil. Selon des publications récentes, ce syndrome semble pouvoir s’associer à des anomalies cardiovasculaires.
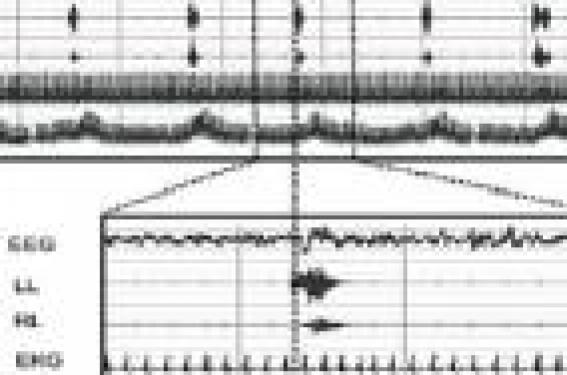
Le syndrome des jambes sans repos (SJSR) est une pathologie fréquente qui affecte 8,5 % de la population avec une nette prédominance féminine (10,8 % des femmes, 5,8 % des hommes) selon l’étude INSTANT (1). Le début peut se situer à tout âge, avec un pic vers 50 ans, ou parfois plus tôt dans les formes familiales ou à l’occasion d’une grossesse. L’évolution est chronique, parfois entrecoupée de longues rémissions. Comment diagnostiquer un SJSR ? Le diagnostic est uniquement clinique. Il est évoqué devant une plainte de gêne dans les jambes souvent associée à une insomnie d’endormissement. Le diagnostic positif Il repose sur l’association de quatre critères. Le besoin impérieux de bouger les membres inférieurs correspondant à des « impatiences » : ce besoin est souvent associé à des sensations désagréables (dysesthésies). Il s’agit d’agacements parfois difficiles à décrire de façon précise : fourmillements, picotements, tiraillements, décharge électrique, insectes sous la peau, brûlures, voire de douleurs indéfinissables, latérales ou unilatérales. Les dysesthésies sont souvent localisées aux membres inférieurs, notamment aux mollets, aux genoux et aux cuisses. Elles peuvent parfois atteindre les membres supérieurs et le tronc dans les formes sévères. Elles s’accompagnent fréquemment de secousses musculaires involontaires, périodiques ou non. Le trouble apparaît ou s’aggrave lors des périodes de repos ou d’inactivité, particulièrement en position allongée ou assise. Les situations passives favorisent sa survenue : cinéma, télévision, longs voyages en avion ou en voiture. Certaines personnes en viennent à éviter ces situations où il est difficile de bouger et renoncent à aller au spectacle ou à prendre les vols longs courriers. Une activité mentale intense diminue les symptômes ou même évite leur apparition. Le trouble est soulagé par le mouvement, notamment la marche ou les étirements, au moins temporairement et aussi longtemps que dure l’activité. Chaque patient développe ses propres stratégies pour diminuer les sensations désagréables : marche pieds nus sur un carrelage froid, massages ou frictions, rotation des pieds ou mouvements de flexion-extension, lecture en déambulant, douche sur les jambes, etc. Il existe une répartition circadienne évocatrice : ce trouble apparaît ou s’aggrave nettement le soir et pendant la première moitié de la nuit. Il est souvent responsable de troubles du sommeil, le plus souvent à type de difficultés d’endormissement, mais aussi de perturbations de la continuité du sommeil, pouvant engendrer une fatigue, des difficultés de concentration, une irritabilité, voire une somnolence diurne excessive dans 20 % des cas environ. Quels sont les principaux diagnostics différentiels ? L’insuffisance veineuse : les symptômes sont plutôt à type de sensations de lourdeur des membres inférieurs. Ces sensations sont aggravées par la station debout et calmées par le décubitus. L’artérite des membres inférieurs : les douleurs apparaissent à la marche et sont calmées par le repos. Les douleurs neuropathiques, qui sont en général des douleurs permanentes. Elles ne sont pas aggravées par le repos, ni améliorées par la marche et ne présentent pas de recrudescence le soir et en début de nuit. Un examen électromyographique permet d’affirmer le diagnostic. Toutefois, l’association d’une neuropathie périphérique et d’un SJSR est assez fréquemment rencontrée. L’acathisie liée au traitement neuroleptique : il s’agit d’une tension intérieure et d’un besoin de bouger tout le corps qui peuvent être majorés après la prise de neuroleptiques et qui ne présentent pas de recrudescence vespérale ; au contraire, les manifestations disparaissent généralement au coucher. Les explorations complémentaires : Doppler, EMG des membres inférieurs ne sont pas nécessaires au diagnostic du SJSR. Dans l’acathisie, les manifestations disparaissent généralement au coucher. Le syndrome des mouvements périodiques des jambes au cours du sommeil (SMPJ) Le syndrome des jambes sans repos est souvent accompagné de mouvements involontaires, périodiques ou non, associés aux symptômes sensitifs à l’éveil en période de repos, ou survenant pendant le sommeil et alors souvent méconnu. Le SMPJ représente le versant moteur nocturne du SJSR (2). Il est présent chez 80 % des patients présentant un SJSR. Il est caractérisé par la survenue de mouvements involontaires stéréotypés et répétitifs à type de contractions toniques ou polycloniques prédominant aux membres inférieurs. En général, le sujet n’en a pas conscience, mais ils sont perçus par le partenaire de lit pour lequel ils peuvent constituer une nuisance importante. Il s’agit généralement d’une dorsiflexion du pied souvent accompagnée d’une extension du gros orteil et parfois d’une flexion du genou et de la hanche, se répétant habituellement à intervalles de 20 à 40 secondes, avec une prédominance en première moitié de la nuit, surtout en sommeil lent léger. Ce syndrome est associé aux mêmes pathologies dans les formes secondaires de SJSR. Sa prévalence augmente fortement avec l’âge (29 % de la population après 50 ans). Un SMPJ peut exister sans trouble sensitif diurne ; un SJSR n’est observé que chez 30 % des patients qui ont un SMPJ. La réalisation d’une polysomnographie (PSG) n’est pas nécessaire au diagnostic de SJSR, et la découverte de MP lors d’une PSG n’est ni nécessaire ni suffisante pour affirmer un diagnostic de SJSR. Les MP par eux-mêmes sont rarement causes d’insomnie ou d’hypersomnie, mais ils sont responsables d’un sommeil peu récupérateur : une PSG peut être indiquée dans ce contexte. Lorsque l’on suspecte cliniquement un SJSR, l’existence de mouvements périodiques des membres au cours du sommeil, la notion d’antécédents familiaux et la sensibilité aux dopaminergiques confortent le diagnostic. Figure. Variations de l’ECG (EKG) et de la pression artérielle (BP) et de l’électro-encéphalogramme (EEG) au cours des mouvements périodiques de jambes (LL et RL). Échelle compacte (A) et échelle élargie (B) (4). Comment déterminer la sévérité du SJSR ? Cette sévérité peut être évaluée de manière subjective par un questionnaire qui a fait l’objet d’un consensus international (tableau). Échelle de sévérité du syndrome des jambes sans repos (SJSR) (7) Cette échelle d’évaluation est composée de 10 questions cotées de 0 à 4. Le score final varie de 0 à 40. L’atteinte est considérée comme : - modérée si le score est compris entre 10 et 20 ; - sévère si le score varie de 21 à 30 ; - très sévère de 31 à 40. Selon l’étude INSTANT1, la gravité est considérée comme légère chez 44 % des sujets, modérée chez 35 %, sévère chez 17 % et très sévère chez 4 %. SJSR et maladies cardiovasculaires Une étude transversale récente sur une cohorte de plus de 3 000 sujets, base de l’étude de la relation troubles respiratoires du sommeil et maladie cardiovasculaire, a mis en évidence un risque relatif de maladie coronaire, d’insuffisance cardiaque et d’AVC doublé chez les patients ayant un SJSR après ajustement sur l’âge, le sexe, l’IMC, l’existence d’un diabète, d’une dyslipidémie et d’une HTA (3). Le mécanisme n’en est pas clair, mais il pourrait être lié à la mauvaise qualité du sommeil ou à l’activation sympathique avec tachycardie et pics hypertensifs répétitifs, qui accompagne les mouvements périodiques nocturnes souvent associés au SJSR (4) (figure). Comment effectuer la recherche étiologique ? Dans les formes primaires ou idiopathiques, environ 40-60 % sont familiales, et plusieurs gènes sont impliqués (5). Les formes secondaires sont associées à des pathologies très variées. Dans tous les cas, il semble exister des troubles de la transmission dopaminergique (6), engendrant un déséquilibre entre divers mécanismes inhibiteurs ou excitateurs au niveau spinal ou supraspinal. Le fer, cofacteur de la tyrosine hydroxylase, est impliqué dans la synthèse de la dopamine ; la prévalence du SJSR est élevée en cas d’anémie ferriprive, mais une ferritinémie normale (supérieure à 50 μg/l) n’élimine pas un déficit en fer dans certains noyaux gris centraux. Outre les formes primaires idiopathiques, dans lesquelles il existe généralement une histoire familiale, de nombreuses formes secondaires ont été décrites. L’association fréquente à la grossesse (20 % des cas) ou à des pathologies très variées n’est pas purement fortuite. Les bouleversements hormonaux ou une éventuelle carence en fer pendant la grossesse interfèrent avec le métabolisme dopaminergique. La prévalence du SJSR est élevée dans l’insuffisance rénale et diminue considérablement après transplantation. Parmi les autres causes possibles, il faut citer l’insuffisance cardiaque, les carences ferriques avec ou sans anémie, ce qui nécessite une détermination systématique du taux plasmatique de ferritine, les dons du sang répétés, les polyneuropathies, la maladie de Parkinson, la polyarthrite rhumatoïde, la bronchopneumopathie chronique obstructive, les leucémies, le diabète, le déficit en vitamine B12 ou en folates, l’hypothyroïdie. Le SJSR pourrait être à la fois cause et conséquence de dépression. Le SJSR est également rencontré dans de nombreuses pathologies de la veille et du sommeil : narcolepsie, troubles du comportement en sommeil paradoxal, syndrome d’apnées du sommeil, syndrome d’hyperactivité avec déficit attentionnel. Certaines causes sont iatrogènes, imputées à l’utilisation de bêtabloquants, d’inhibiteurs calciques ou d’antihistaminiques. De nombreux psychotropes peuvent également être impliqués tels les neuroleptiques, le lithium, les antidépresseurs, qu’il s’agisse d’inhibiteurs de la recapture de la sérotonine ou de tricycliques. La consommation d’alcool, de thé ou de café le soir peut faire apparaître ou majorer les symptômes. La recherche étiologique doit comporter les causes iatrogènes et les causes secondaires en particulier à un déficit en fer par dosage de la ferritinémie. Quel traitement peut-on proposer ? Dans les formes idiopathiques : dans les formes légères, une approche non pharmacologique peut être suffisante : éviter les excitants surtout le soir (alcool, thé, café), éviter les occupations passives, préconiser une activité physique modérée, respecter une bonne hygiène du sommeil. Des symptômes peu fréquents peuvent justifier une utilisation occasionnelle d’agonistes dopaminergiques, voire de L-Dopa à petite dose, de dextropropoxyphène ou de codéine. Dans les formes modérées à sévères, il existe un consensus international pour proposer en première intention les agonistes dopaminergiques : ropirinole, pramipexole, piribidil, rotigotine… Les agonistes ergotés sont à éviter en raison du risque de fibrose ou de valvulopathie cardiaque. Le ropinirole (Adartrel®) est remboursé uniquement dans les formes très sévères (score > 30) (tableau) et la prescription initiale doit être réalisée en consultation spécialisée. Les nausées et vomissements sont les effets secondaires les plus fréquents en début de traitement et sont traités par la dompéridone. Quelques phénomènes de somnolence ont été décrits et justifient des précautions concernant la conduite automobile. L’insuffisance rénale sévère et l’insuffisance hépatique constituent des contre-indications. Le pramipexole (Sifrol®) a également l’AMM en France. La rotigotine devrait permettre une délivrance continue par patch cutané mais n’est pas encore commercialisée. Le phénomène d’« augmentation » est essentiellement une complication du traitement par la L-Dopa, il est beaucoup plus rare avec les agonistes dopaminergiques prescrits à dose modérée. Il serait dû à des modifications de la sensibilité des récepteurs synaptiques et se caractérise par : - une apparition plus précoce des symptômes dans la journée ; - une aggravation des symptômes ; - un raccourcissement de la latence d’apparition des symptômes quand le sujet est au repos ; - une extension aux quatre membres, voire au tronc. Il nécessite une baisse de la posologie ou un changement d’agoniste dopaminergique en privilégiant les molécules à demi-vie longue. Il peut parfois être nécessaire d’arrêter totalement les dopaminergiques et d’administrer des opiacés type oxycodone pendant quelques semaines à quelques mois. Dans les formes secondaires : outre le traitement des pathologies causales, il faut chercher à modifier les médicaments qui peuvent être en cause et supplémenter en fer en cas de carence martiale (ferritinémie < 50 μg/l). Dans les formes sévères résistantes aux agonistes dopaminergiques, plusieurs classes de molécules peuvent être utilisées : benzodiazépines, notamment le clonazépam (Rivotril®), gabapentine ou neurontin dans les formes secondaires associées à une neuropathie périphérique ou opiacés dans les formes sévères et résistantes.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :