Publié le 23 nov 2011Lecture 9 min
Traitements novateurs de la maladie d’Alzheimer
S. BOMBOIS*, S. SCHRAEN**, F. PASQUIER*, M.-A. MACKOWIAK*, Université Lille-Nord de France, *CMRR de Lille, **Service de biochimie et de biologie moléculaire, Inserm U837, Lille
Deux classes thérapeutiques ayant une action symptomatique sont disponibles dans la maladie d’Alzheimer (MA) : celle des inhibiteurs de l’acétylcholinestérase et un antagoniste non compétitif des récepteurs NMDA du glutamate. De nouvelles pistes de recherche sont évaluées, privilégiant des molécules capables de modifier le cours évolutif de la maladie sur le long terme, avec un effet sur la physiopathologie de la maladie (1). Ces thérapeutiques, dites disease modifiers, ont été développées en connaissance des mécanismes physiopathologiques de la MA (cascade amyloïde, dégénérescence neurofibrillaire), et de cibles moins spécifiques (stress oxydatif, inflammation, etc.). de la MA
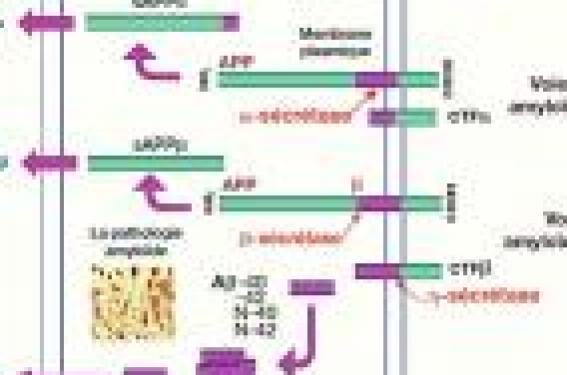
Physiopathologie de la MA Des modifications métaboliques conduisent à la formation et à l’agrégation en polymères insolubles de peptides amyloïdes dans l’espace extracellulaire et de protéines tau hyperphosphorylées dans les neurones. Ces deux lésions (plaques amyloïdes et dégénérescences neurofibrillaires – DNF) sont la signature neuropathologique de la MA. Selon l’hypothèse de la cascade amyloïde, les dépôts amyloïdes sont à l’origine du dysfonctionnement, puis de la mort neuronale. Le peptide amyloïde Selon l’hypothèse de la cascade amyloïde, les dépôts amyloïdes sont à l’origine du dysfonctionnement, puis de la mort neuronale. Le peptide amyloïde est naturellement produit dans le cerveau. Il provient de la maturation physiologique de la protéine transmembranaire APP (Amyloïd precursor protein), par coupures enzymatiques produites par des sécrétases. C’est la voie amyloïdogène (figure 1). Les β- et γ-sécrétases libèrent respectivement les extrémités Net C-terminales du peptide amyloïde, la coupure en C-terminale pouvant être de 40 (Aβ-40) ou 42 (Aβ-42) acides aminés. Les peptides amyloïdes Aβ-40 et Aβ- 42 sont les constituants essentiels des plaques amyloïdes. Les peptides Aβ-42 forment des oligomères (agrégats de 2 à 12 peptides) neurotoxiques qui se déposent essentiellement sous forme de fibrilles, constituant la forme majoritaire des dépôts. Des glycosaminoglycanes favorisent la fibrillation et l’agrégation du peptide Aβ. Le peptide Aβ-40 pourrait jouer un rôle protecteur en inhibant l’agrégation des monomères d’Aβ-42 en oligomères toxiques. Le peptide Aß est catabolisé par des enzymes, comme la néprilysine. L’autre voie physiologique du métabolisme de l’APP est la voie de l’α-sécrétase, non amyloïdogène (figure 1). La coupure induite par cette enzyme prévient la production de peptides Aß. Figure 1. Voies amyloïdogène et non amyloïdogène. Figure 2. Hyperphosphorylation de la protéine tau dans la maladie d’Alzheimer. La protéine tau La protéine tau est une protéine neuronale associée aux microtubules du cytosquelette dont elle favorise l’assemblage et la stabilisation. Cette fonction, régulée par phosphorylation, est essentielle pour maintenir les transports neuronaux. Lors de la MA, la phosphorylation de tau par des phosphokinases, comme GSK3, est perturbée avec une hyperphosphorylation et de nouveaux sites de phosphorylation « pathologiques ». La protéine tau anormalement phosphorylée (P-tau) perd sa fonction stabilisatrice et s’agrège dans le neurone sous forme de fibrilles pathologiques pour conduire à la DNF. La protéine tau semble avoir d’autres fonctions cruciales pour la survie des neurones. Selon l’hypothèse de la cascade amyloïde, les modifications de tau et la formation de DNF seraient déclenchées par les concentrations toxiques de peptides amyloïdes. Aux plaques amyloïdes et DNF s’associent des processus inflammatoires et des dysfonctionnements neuronaux, axonaux et synaptiques. Marqueurs de sélection des patients et d’efficacité pour les essais de traitements disease modifiers De nombreuses études, en particuliers celles du groupe ADNI (Alzheimer’s disease neuroimaging), ont contribué à définir les biomarqueurs les plus appropriés pour sélectionner les patients avec une pathologie Alzheimer à un stade prédémentiel et à risque de progression. Il s’agit des biomarqueurs du liquide céphalorachidien (protéines tau totales [T-tau], tau phosphorylées [P-tau] et Aβ-42), du génotypage de l’ApoE, ainsi que des marqueurs d’imagerie structurelle comme la réduction du volume hippocampique et de marqueurs d’imagerie fonctionnelle et moléculaire montrant un hypométabolisme dans la région cingulaire postérieure ou la présence de plaques amyloïdes. La pertinence diagnostique et pronostique de ces marqueurs dépend du stade de la maladie. Thérapeutiques innovantes Thérapeutiques anti-amyloïde Le modèle de la cascade amyloïde restant une hypothèse physiopathologique majeure, plusieurs stratégies visent à prévenir la formation du peptide amyloïde en inhibant sa production, son agrégation ou en favorisant son élimination. • Ce sont les essais d’immunisation anti-amyloïde qui ont été les plus développés suite aux résultats de travaux expérimentaux sur des modèles animaux montrant une réduction de la formation et de l’accumulation de plaques amyloïdes cérébrales après injection d’anticorps anti-amyloïdes. Un premier essai de phase II (AN- 1792) a constaté une diminution de la protéine tau dans le liquide céphalorachidien des malades vaccinés produisant des anticorps dirigés contre le peptide Aβ, et une réduction des plaques amyloïdes dans les cerveaux des patients autopsiés (2). Cependant, cet essai a rapidement été interrompu en 2002 en raison de la survenue précoce de méningoencéphalites aseptiques (chez 6 % des sujets traités). Actuellement, d’autres études sont en cours pour tester l’injection de fragments plus courts du peptide Aβ-42, dont la tolérance serait meilleure, et de différents adjuvants. • Une alternative à l’immunisation active est l’immunisation passive avec administration directe d’anticorps monoclonaux anti-amyloïde humanisés. Plusieurs essais sont en cours, le plus avancé étant conduit avec le bapineuzumab chez plus de 1 000 sujets en phase III. Le bapineuzumab a mont ré une réduct ion en imagerie fonctionnelle des plaques amyloïdes (3), mais les premiers résultats sur l’efficacité clinique sont incertains, spécialement chez les sujets porteurs de l’allèle ApoE 4, chez lesquels le risque d’oedème vasogénique cérébral est accru. • Un essai testant un antiamyloïde par voie orale (tramiprosate) susceptible de limiter la formation d’agrégats d’oligomères du peptide Aβ s’est révélée négatif aux États-Unis et a été stoppée fin 2007 en Europe. • Une autre approche consiste à inhiber la voie impliquant les γ- et β-sécrétases. Cependant, il existe différentes γ-sécrétases et des effets indésirables sévères ont été décrits lors des premiers essais d’inhibiteurs liés en partie au blocage de voies de transduction essentielles (hémorragies digestives, cancers cutanés, etc.). Ainsi, les premiers résultats du semagacestat ont été décevants à la fois sur la tolérance et l’efficacité, avec une dégradation cognitive plus rapide chez les patients traités par la molécule active que chez ceux prenant le placebo. Néanmoins, d’autres études sont en cours avec une plus grande sélectivité pour l'inhibition de la synthèse de la protéine β-amyloïde (BMS-708163, begacestat, etc.). Des inhibiteurs de β-sécrétases sont également en cours d’évaluation, mais présentent des difficultés liées aux multiples substrats de ces enzymes. • Une alternative aux inhibiteurs de β- et γ-sécrétases consiste à agir sur la voie non pathogène du catabolisme de l’APP en stimulant l’α-sécrétase. Un essai de phase II a, avec l’etazolate (EHT-0202), a obtenu des résultats encourageant la poursuite du développement de la molécule (4). Les perspectives thérapeutiques plus récentes ont pour cible la protéine tau. Réduire l’agrégation de la protéine tau Les perspectives thérapeutiques plus récentes ont pour cible la protéine tau, grâce à l’identification de nombreux sites de phosphorylation, et la dégénérescence neurofibrillaire. C’est le cas d’inhibiteurs de kinases (GSK3), de modulateurs de kinases et de phosphatases. Le méthylthioninium chloride (bleu de méthylène, es sai Rember) a également démontré sa capacité à dissoudre les filaments de protéine tau et à prévenir leur agrégation. Autres voies de recherche De nombreuses autres molécules sont en cours d’évaluation, comme les antagonistes des récepteurs histaminiques H3, les agonistes des récepteurs nicotiniques, les agonistes des récepteurs sérotoninergiques (5-HT4 et 6), les facteurs neurotrophiques (NGF), etc. Des résultats préliminaires encourageants ont été publiés en 2008 avec la latrepirdine (Dimebon®), antihistaminique non sélectif agissant sur la survie mitochondriale et le stress oxydatif cellulaire (5), mais n’ont pas été confirmé lors de la phase III multicentrique de cette étude. Suite aux échecs de nombreuses études en phase III au cours des dernières années, trois questions se posent sur la stratégie des essais thérapeutiques modifiant la physiopathologie de la maladie : • trop tard ? (si les lésions étaient trop importantes au moment de l’intervention thérapeutique pour espérer une amélioration clinique significative) ; • trop court ? (si l’intervention thérapeutique n’était pas suffisamment longue pour une maladie lentement progressive de progression variable) ; • trop hétérogène ? (si tous les patients dans les études n’avaient pas les lésions Alzheimer supposées ciblées par le traitement). C’est pourquoi une réflexion générale est menée sur le déroulement des essais thérapeutiques de phase précoce dans la MA, avec la nécessité d’associer à l’évaluation des molécules étudiées des biomarqueurs qui permettraient de faire la preuve que la cible choisie est pertinente et de stopper, le cas échéant, le développement d’un produit insuffisamment efficace, en mettant l’accent sur les preuves de mécanisme d’action et de concept. Une réflexion générale est menée sur le déroulement des essais thérapeutiques de phase précoce dans la MA.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :





