Publié le 03 jan 2020Lecture 11 min
Quelle anticoagulation après un AVC ?
Peggy REINER, Mikael MAZIGHI*, service de neurologie, hôpital Lariboisière, Paris ; DHU NeuroVasc *Université Paris Denis Diderot
Les accidents vasculaires cérébraux (AVC) se définissent par la survenue brutale d’un déficit neurologique focal transitoire ou permanent. Les AVC peuvent être ischémiques (80 %) ou hémorragiques (20 % des cas), et seule l’imagerie cérébrale permet aujourd’hui de distinguer ces deux entités. Ils représentent en France la 1re cause de handicap, la deuxième cause de démence et la première cause de décès chez la femme(1).
Malgré la courte fenêtre thérapeutique et le risque de transformation hémorragique qui limitent le nombre de patients éligibles (< 10 %) aux thérapeutiques de phase aiguë(2), ces dernières ont considérablement progressé avec le développement notamment de la thrombectomie. Ils permettent d’éviter jusqu’à un cas de dépendance pour 4 patients traités(3). Le pronostic des AVC pourrait nettement s’améliorer dans les années à venir en assurant une prévention efficace contre la récidive, ce qui constitue donc un axe majeur de la prise en charge de ces patients.
Qu’il s’agisse d’AVC ischémique ou hémorragique, la question d’une anticoagulation efficace se pose fréquemment à l’heure où la prévalence de la fibrillation atriale (FA) augmente en même temps que le vieillissement de la population(4).
L’accès à plusieurs classes thérapeutiques et les données de la littérature permettent aujourd’hui d’ajuster au mieux le traitement au patient et à son type d’AVC.
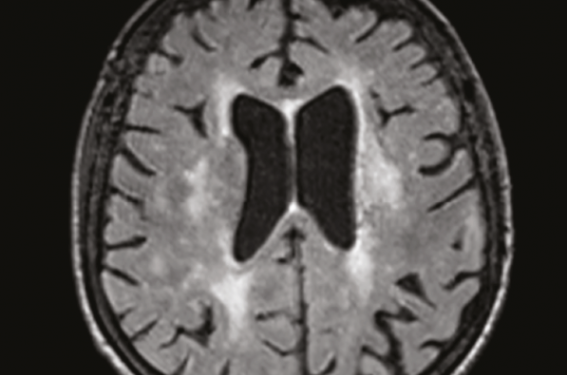
Figure 1. IRM séquence flair en coupe axiale montrant une leucopathie d’origine microvasculaire périventriculaire.
Prévention de la récidive après un AVC ischémique
Tous les patients victimes d’un AVC bénéficient d’une prise en charge au sein d’une unité neuro-vasculaire (UNV). L’objectif de l’UNV est de prévenir les complications, l’aggravation et de débuter la rééducation précoce permettant une réduction de la mortalité et de la dépendance de 20 % en dehors de toute thérapeutique spécifique (thrombolyse, thrombectomie)(5). L’un des principaux axes de cette prise en charge spécialisée consiste à adapter la prévention secondaire, et notamment le traitement antithrombotique en fonction du bilan étiologique. En effet, si le patient victime d’un AVC ischémique est à haut risque de récidive en raison de son terrain vasculaire et/ou de l’événement embolique récent, il est également exposé à un sur-risque d’hémorragie cérébrale (transformation hémorragique d’une lésion ischémique, extension d’un hématome, saignement sur des lésions de microangiopathie).
La décision de débuter un traitement anticoagulant va donc peser sur la balance entre la réduction de risque ischémique et l’augmentation de risque de complications hémorragiques surtout cérébrales.
Les étiologies des AVC ischémiques se répartissent à peu près équitablement entre l’athérothrombose, la maladie des petites artères cérébrales, les cardiopathies emboligènes et les accidents dits cryptogéniques (c’est-à-dire de cause inconnue). Il existe quelques variations en fonction de l’âge avec une plus grande prévalence des cardiopathies emboligènes au-delà de 75 ans et davantage d’AVC cryptogéniques avant 40 ans. Les causes plus rares comme les dissections artérielles cervicales ou les troubles de la coagulation représentent moins de 5 % des étiologies, sauf pour les sujets jeunes où les dissections artérielles représentent la première cause d’AVC ischémiques(6).
La FA représente la principale indication à une anticoagulation efficace. Dans 10 % des cas, le diagnostic est porté au cours des premiers jours soit au moment de la prise en charge en UNV. Dans 11 % des cas, la FA sera identifiée sur les holters ECG prolongés (c’est-à-dire de 30 jours)(7,8). Le risque de récidive embolique est supérieur à 7 % par an après un AVC ischémique ou un AIT récent, il est sous-estimé par le score CHA2DS2-VASc notamment chez les patients sans facteur de risque(9,10).
Indications à une anticoagulation efficace en prévention secondaire hors FA
Le risque embolique en présence d’un flutter auriculaire est moins connu, mais la fréquente association à des épisodes de FA justifie qu’il soit recommandé d’appliquer le même traitement en prévention secondaire que pour la FA(11-13).
D’autres étiologies plus rares peuvent faire discuter d’une anticoagulation comme l’existence d’un thrombus endocavitaire, une insuffisance cardiaque avec fraction d’éjection du ventricule gauche inférieure à 30 %, ou un athérome de la crosse aortique significatif (plaque > 4 mm). Pour l’athérome aortique, l’anticoagulation n’a pas montré sa supériorité par rapport aux antiplaquettaires. L’étude ARCH qui comparait l’association aspirine-clopidogrel aux AVK a été arrêtée précocement en raison des difficultés de recrutement. Par ailleurs, le taux d’événement faible dans cette étude ne permettait de tirer aucune conclusion(14). Selon les recommandations HAS de 2008, une anticoagulation est, toutefois, envisagée pendant quelques semaines, en cas d’éléments mobiles évocateurs de thrombus associés à la plaque. Dans les dissections artérielles cervicales pouvant être à l’origine d’AVC ischémique par embolie d’artère à artère, l’anticoagulation efficace est parfois utilisée, mais les antiplaquettaires semblent tout aussi efficaces et les dernières données de la littérature ne montrent pas de différence en termes de prévention des AVC(15).
Récemment, le concept d’ESUS (Embolic Stroke of Unknown Source) a été développé afin d’évaluer si une anticoagulation efficace par anticoagulant oral direct (AOD) est plus efficace que l’aspirine en prévention secondaire dans les cas d’AVC ischémique non lacunaire, non associé à la présence d’une cardiopathie emboligène avérée ou d’une sténose artérielle supérieure à 50 %. Actuellement, seuls les résultats d’une étude comparant l’aspirine au rivaroxaban 15 mg par jour sont disponibles avec une interruption précoce de l’essai en raison d’une augmentation du nombre de complications hémorragiques(16). Une étude similaire a été menée avec le Pradaxa®.
Un cas particulier est à mentionner dans les indications formelles à une anticoagulation efficace, il s’agit de la thrombose veineuse cérébrale (TVC).
Rares, les TVC représentent moins de 1 % des AVC(17,18), la symptomatologie polymorphe, en dehors des céphalées, retarde souvent le diagnostic. La TVC peut se compliquer de lésions oedémateuses ou hémorragiques. Quelle que soit la présentation, le traitement repose sur une anticoagulation efficace par héparine (HNF ou HBPM) relayée par des AVK pour au moins 3 mois. Il s’agit de la seule situation où une anticoagulation sera commencée dès le diagnostic même en cas de transformation hémorragique.
Type de traitement anticoagulant
En cas de FA, le traitement anticoagulant par AVK réduit significativement le risque de récidive ischémique en prévention secondaire(19) comparativement à l’aspirine ou au placebo. Les AOD, qu’ils s’agissent des anti-Xa ou anti-thrombine ont été développés comme alternative aux AVK. Leur efficacité et tolérance ont été évaluées par des essais cliniques randomisés contrôlés comparativement à la warfarine dans de larges populations de patients avec une FA. Une métaanalyse de ces grands essais (71 683 participants des études RE-LY, ROCKET AF, ARISTOTLE et ENGAGE AF-TIMI 48) a montré en prévention primaire une réduction de 19 % des AVC et embolies systémiques, avec notamment une réduction des AVC hémorragiques(20). Le taux d’hémorragies dans les groupes AVK était toutefois un peu plus élevé que dans la littérature (3 à 4 % vs 1 à 3 %), probablement en raison d’une meilleure anticoagulation (TTR > 65 %) que dans d’autres études observationnelles.
Il n’existe pas d’étude de prévention secondaire sur une population de patients ayant tous des antécédents d’AVC, mais les données de sousgroupes des essais initiaux et l’analyse des données de cohorte, notamment au Danemark, montrent une efficacité similaire chez les patients traités en prévention secondaire de l’AVC(21).
Leur facilité d’utilisation à dose unique, sans contrôle biologique et avec un nombre d’interactions médicamenteuses et alimentaires nettement moindre leur confère un avantage évident et ils sont depuis largement utilisés en 1re intention(22). L’apixaban, le dabigatran et le rivaroxaban, disponibles sur le marché en France sont recommandés au même titre que les AVK en prévention primaire et secondaire (recommandations HAS 2018).
Pour mémoire, l’utilisation d’une héparine (HBPM ou HNF) avant l’obtention d’une efficacité des anticoagulants oraux (« bridging strategy ») est associée à une augmentation du risque d’hémorragie symptomatique(23,24) et n’est pas recommandée.
À noter également, qu’il n’existe pas de preuve que l’ajout d’un antiplaquettaire aux anticoagulants réduise le risque ischémique, mais il a été montré une augmentation du risque hémorragique. Dans ces conditions, en dehors de l’existence d’un syndrome coronarien aigu dans l’année précédente, il n’y a pas d’indication à associer ces deux traitements(11,25).
Figure 2. IRM séquence T2* en coupe axiale montrant des microsaignements des noyaux gris profonds.
Après un AVC hémorragique
Les AVC hémorragiques, s’ils ne sont pas directement attribuables à un traitement anticoagulant (surdosage), surviennent dans près de la moitié des cas sous antithrombotique, dont 10 à 12 % d’anticoagulants(26). Chez ces patients, l’anticoagulation est majoritairement introduite en raison d’une cardiopathie emboligène. Malgré la fréquence de cette situation, il n’existe pas d’étude randomisée contrôlée permettant d’établir des recommandations de haut niveau de preuve sur la reprise du traitement anticoagulant. La décision de reprendre ou d’instaurer une anticoagulation efficace chez un patient ayant un antécédent d’hémorragie cérébrale repose sur la balance bénéfice-risque entre la survenue d’une ischémie et celui d’une récidive hémorragique. Le risque ischémique peut être estimé à l’aide du score CHA2DS2-VASc(27), alors que le risque de récidive d’hémorragie cérébrale dépend du score HASBLED et de la pathologie sous-jacente.
Plus de 80 % des hématomes cérébraux sont consécutifs à une atteinte des petites artères cérébrales dont il existe deux types anatomopathologiques, l’artériosclérose en rapport avec l’âge et l’HTA, et plus rarement l’angiopathie amyloïde cérébrale (AAC).
L’AAC se caractérise par un risque de récidive hémorragique élevé (jusqu’à 20 % par an(28)). Dans l’AAC, les hémorragies sont lobaires et peuvent s’associer à une leucopathie à prédominance postérieure, ainsi qu’une hémosidérose corticale sur l’IRM. Le risque de récidive hémorragique est moindre dans l’artériosclérose (2 % par an). Dans cette situation, les hémorragies sont le plus souvent profondes même si la topographie lobaire reste possible.
Actuellement, l’évaluation du risque de récidive hémorragique repose sur des données observationnelles et est stratifiée sur la base de l’imagerie. Ainsi une métaanalyse sur des études de cohortes portant sur 1 306 patients ayant présenté un hématome cérébral a évalué le risque de récidive d’hémorragie cérébrale à plus de 7 % par an en présence d’une atteinte strictement lobaire contre 1,1 % dans les autres topographies d’hémorragie(29).
À noter que la seule présence de microsaignements ne constitue pas une contre-indication au traitement anticoagulant, avec un risque annuel d’hémorragie estimé à 0,5 % par an.
Mais en cas d’hémorragie, la présence de microsaignements augmente le risque de récidive hémorragique annuel de 4,6 % à 11,2 %(30). Ainsi la topographie lobaire et la présence de microsaignements exposent à un risque de récidive hémorragique significativement plus élevé.
En pratique, l’anticoagulation efficace reste sous-utilisée chez ces patients, or le risque embolique est souvent supérieur au risque hémorragique et une métaanalyse sur données individuelles de patients chez qui l’anticoagulation a été reprise après une hémorragie cérébrale, suggère une amélioration du pronostic fonctionnel(31) quelle que soit la topographie de l’hématome. Plusieurs études randomisées ont débuté afin de comparer la prise d’AOD, la fermeture de l’auricule ou l’abstention thérapeutique après une hémorragie cérébrale chez les patients en FA. Dans l’attente des résultats, un traitement par AOD semble raisonnable sauf en cas de forte suspicion d’AAC. Un contrôle strict de la pression artérielle doit dans tous les cas être associé(32) afin de réduire le risque de récidive hémorragique.
Délai d’introduction
L’anticoagulation efficace n’a pas sa place dans les premières heures de la prise en charge des AVC ischémiques.
Les études évaluant son intérêt à la phase aiguë ont toujours montré une augmentation du risque de transformation hémorragique sans bénéfice clinique. Une métaanalyse de 7 essais randomisés comparant l’anticoagulation efficace dans les 48 premières heures (HBPM ou HNF) à l’aspirine ou au placebo(33) portant sur 4 624 patients n’a pas montré de différence significative en termes de mortalité ou handicap. Il est rapporté une réduction non significative des récurrences ischémiques, mais une augmentation du nombre hémorragie intracrânienne.
Bien que le risque de récidive ischémique soit élevé durant les premiers jours en cas de FA (0,4 à 1,3 % par jour durant les 2 premières semaines selon les études), il est comparable au risque hémorragique estimé sous anticoagulation efficace durant cette période (1 % par jour)(34). Aucune étude randomisée n’a évalué l’efficacité et la sécurité d’une anticoagulation efficace durant les premières semaines. Les recommandations nord-américaines sont en faveur d’une introduction du traitement anticoagulant 14 jours après l’AVC(11). Toutefois, les données d’une étude observationnelle sur 1 029 patients(24) ont montré un délai « optimal », pour introduire les anticoagulants, entre 4 et 14 jours. D’autres études sur les AVK ont mis en évidence une réduction du risque ischémique sans augmentation du risque hémorragique lors de l’obtention d’un INR dans la cible thérapeutique à 7 jours de l’AVC. Enfin, les données de registres et quelques études observationnelles n’ont pas montré d’augmentation du risque hémorragique lors de l’introduction des AOD dans les 4 à 7 jours(35-37).
Ces dernières années, les recommandations européennes(22) ont été modifiées proposant, par consensus d’experts, d’introduire les anticoagulants plus rapidement après un AVC ischémique. Le délai étant stratifié selon la taille de la lésion et de la sévérité clinique (J1 pour les AIT ; J3 si score NIHSS ≤ 8, J6 si 8 < NIHSS ≤ 15 et J12 si NIHSS > 16). Il est, par ailleurs, recommandé de contrôler la pression artérielle dans tous les cas et de réaliser une imagerie de contrôle si l’AVC est modéré à sévère.
En cas de cardiopathie à très haut risque (valve mécanique notamment), le délai de réintroduction peut être réduit à quelques jours après discussion collégiale entre neurologues et cardiologues.
En pratique
L’anticoagulation efficace n’a qu’une place extrêmement limitée dans les premières 24 h après un AVC ischémique en raison du risque de complication hémorragique.
Le délai optimal d’introduction des anticoagulants n’a pas été évalué de façon randomisée, mais en prévention secondaire l’initiation doit la plupart du temps être discutée dans la 1re semaine.
Après un AVC hémorragique, sur la base essentiellement de données d’études observationnelles, le risque de récidive hémorragique semble inférieur au risque ischémique en cas de FA.
L’anticoagulation efficace est donc à envisager en dehors des cas de forte suspicion d’angiopathie amyloïde cérébrale.
Publié dans Cardiologie Pratique
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :